Medin Blog nasce con l’obiettivo di incoraggiare la divulgazione scientifica, all’interno di uno spazio digitale dinamico ed interattivo.
Una maggiore comprensione e consapevolezza può aiutare ad orientarsi nelle scelte di carattere sanitario, oltre ad essere un valido incentivo al sostegno dell’innovazione scientifica.
Contenuti in Evidenza

NUOVE SOLUZIONE CONSERVATIVE NEL TRATTAMENTO DELL’OSTEOARTROSI: CONDROPROTEZIONE E VISCOSUPPLEMENTAZIONE
by Dott. Alessandro Cerino | 23 Aprile 2024 | Articoli | 0 Comments
In Italia le malattie reumatiche colpiscono circa 5 milioni e mezzo di abitanti, un decimo della popolazione totale. Tra queste, l’Osteoartrosi (OA) è di gran lunga l’affezione più frequente, rappresentando da sola circa il 72% dei casi con un’incidenza che aumenta con l’aumentare dell’età [1].
L’OA è un processo patologico di natura degenerativa che trae origine dalla perdita del fisiologico equilibrio tra fenomeni catabolici e fenomeni riparativi a livello della cartilagine articolare. Il processo coinvolge anche l’osso subcondrale, la membrana sinoviale e determina uno scompenso globale a carico dell’articolazione.
La patogenesi dell’artrosi non è stata ancora completamente chiarita [2]. L’ipotesi più accreditata evidenzia come sollecitazioni meccaniche eccessive che agiscono su una cartilagine normale o alterazioni cartilaginee intrinseche determinino una aumentata produzione da parte dei condrociti di Metalloproteasi di matrice (MMPs), una famiglia di endopeptidasi zinco-dipendenti in grado di degradare la matrice extracellulare, con conseguente degradazione della matrice cartilaginea e liberazione di detriti nel liquido sinoviale. Questi detriti fagocitati dalla membrana sinoviale stimolano i sinoviociti a produrre citochine pro-infiammatorie (principalmente IL-1 e TNF-a) che, a loro volta, inducono i condrociti a produrre NO e PGE2, amplificando così il processo flogistico-degenerativo [3].
L’OA è, per diversi fattori, una patologia particolarmente difficile da trattare: innanzitutto è una patologia che tende a cronicizzare e, in quanto tale necessita di terapie di lungo periodo. La cronicizzazione della patologia si accompagna inoltre allo sviluppo di un’invalidità che, a seconda del decorso della patologia, può essere più o meno grave e comportare costi sociali e personali più o meno elevati [4].
Le linee guida ACR (American College of Rheumatology) 2019 [5] per la gestione del paziente artrosico includono una combinazione di interventi farmacologici (Terapia sintomatica, Terapia intrarticolare e Terapia di fondo) e non farmacologici (perdita di peso, programmi di istruzione del paziente, esercizio fisico e così via), mentre la chirurgia viene di solito riservata solo alle forme più gravi nelle quali il dolore e la difficoltà di movimento impediscono al paziente di condurre una vita normale.
Ad ogni modo, ad oggi, non esistono terapie farmacologiche specifiche in grado di prevenire la progressione del danno articolare causato da OA, ma la terapia standard prevede l’adozione di un regime terapeutico basato su una combinazione di Farmaci sintomatici ad azione rapida (Fast-Acting Drug for OsteoArthritis) e
Farmaci sintomatici ad azione lenta (SYmptomatic Slow-Acting Drugs for OsteoArthritis) [6]. Appartengono alla prima categoria i FANS, gli Analgesici e i Corticosteroidi classici; questi farmaci hanno il vantaggio di esercitare un effetto immediato sugli stati infiammatori responsabili del dolore (quindi sul sintomo), ma non esercitano alcun’azione sulle cause della patologia osteoartrosica e spesso producono effetti collaterali non trascurabili (gestrointestinali, renali e cardiovascolari) che non ne rendono consigliabile l’impiego sul lungo periodo [7,8]. Congiuntamente ai farmaci sintomatici classici è oramai di uso comune nella gestione del paziente con OA il ricorso ai cosiddetti SYSADOA [9-11]. Si tratta di principi attivi in grado di stimolare la sintesi dei principali costituenti della cartilagine articolare (Glicosaminoglicani, Proteoglicani e Collagene), fornendo così nutrimento e sostegno all’articolazione artrosica, conservare le condizioni di vitalità dei ondrociti e mantenere inalterate le caratteristiche del liquido sinoviale [12].
Appartiene a questa categoria tra le altre, l’acido ialuronico (HA) somministrato principalmente per via intrarticolare (viscosupplementazione) [13].
Il concetto di viscosupplementazione (VS) venne introdotto nel 1993 da Balazs [13] come nuova strategia terapeutica per il trattamento di patologie, come l’osteoartrosi, responsabili di un’alterazione qualitativa e quantitativa del liquido sinoviale delle articolazioni.
Balazs per primo ipotizzò che l’iniezione intra-articolare di HA nelle articolazioni osteoartrosiche avrebbe avuto la capacità di ripristinare la viscoelasticità del liquido sinoviale, di aumentare il flusso di liquido articolare, di normalizzare la sintesi endogena di ialuronato, di inibire la degradazione di ialuronato, di ridurre il dolore articolare e di migliorare la funzionalità dell’articolazione [13].
Attualmente, numerosi studi dimostrano con sempre maggior evidenza, come cicli ripetuti di iniezioni ecoguidate intra-articolari di HA, comportino un notevole miglioramento della sintomatologia dolorosa nonché della funzionalità articolare e del consumo di analgesici evidenziando inoltre, un netto ritardo per gli interventi di protesizzazione delle articolazioni interessate dal processo patologico [14,15].
Nonostante ciò, le linee guida e le raccomandazioni delle diverse Società sono spesso in contraddizione tra loro questo perché il principale svantaggio offerto da suddetta terapia è che il processo infiammatorio in corso riduce notevolmente il suo effetto, dal momento che la produzione di enzimi litici, degrada ulteriormente l’articolazione [16].
Ne consegue che molte evidenze hanno cominciato a porre l’accento sull’associazione di VS e condroprotezione orale.
In uno studio randomizzato open label, 40 pazienti con OA del ginocchio di grado lieve-moderato sono stati assegnati a ricevere VS intrarticolare con HA per 5 settimane, seguita o meno da condroprotezione orale per 6 mesi. Entrambi i gruppi hanno riportato significativi benefici alla conclusione della terapia infiltrativa rispetto alla situazione basale, ma solo i pazienti che assumevano condroprotezione orale, hanno mantenuto i punteggi di VAS e Lequesne a 6 mesi significativamente ridotti da quelli basali [17].
La condroprotezione orale, nello specifico prevede l’utilizzo di un gruppo di principi attivi che prendono il nome di Inibitori delle Metalloproteasi di matrice (MMPs). Come visto in precedenza l’attivazione delle MMPs rappresenta il trigger patologico in grado di innescare il processo infiammatorio a livello articolare [18-21].
Bloccare questi enzimi, significa pertanto ritardare la degenerazione cartilaginea, arrestando al contempo il processo flogistico a valle [22,23].
Appartengono a questa categoria: N-Acetil-D-glucosammina, Condroitin solfato, Metilsulfonilmetano e Boswellia serrata.
La N-Acetil-D-Glucosamina (NAG) è un aminozucchero precursore della sintesi dei Glicosaminoglicani (GAGs), i principali costituenti della cartilagine articolare. Così come le altre forme di Glucosammina presenti sul mercato (Glucosammina solfato e Glucosammina cloridrato), la NAG è in grado di stimolare la sintesi dei principali costituenti della matrice cartilaginea (GAGs, PGs e Acido ialuronico), fornendo nutrimento e sostegno trofico all’articolazione. La NAG presenta inoltre dei vantaggi sostanziali che ne incoraggiano l’uso rispetto alle altre forme di Glucosammina [24]. In particolare, a differenza della Glucosammina solfato e cloridrato, la NAG è in grado di operare l’inibizione delle MMPs, rallentando l’erosione della matrice cartilazionea e il conseguente processo di flogosi, stimolare la sintesi di HA, esplicare un’interessante azione antinfiammatoria, non inibire la sintesi di Glucosammina endogena e non indurre insulino-resistenza.
Tant’è vero che, ad oggi, la NAG, rappresenta l’unica forma di Glucosamina ad aver ottenuto una specifica indicazione terapeutica da parte del Ministero della Salute italiano.
Un altro principio attivo in grado di provocare l’inibizione delle MMPs e da tempo utilizzato nella gestione del paziente artrosico è la Condroitin solfato. Quest’ultima, rappresenta il GAG più abbondante a livello della cartilagine articolare, dove ne rappresenta il maggiore responsabile della resistenza alla compressione, tant’è vero che l’impoverimento in Condroitin solfato della cartilagine articolare rappresenta una tra le principali cause di OA [25-29].
Il beneficio apportato dalla Condroitin solfato nei pazienti affetti da OA è presumibilmente il risultato di varie azioni: stimolazione della sintesi di Proteoglicani e Acido ialuronico, inibizione dell’attività erosiva delle MMPs, azione antinfiammatoria e inibizione dell’apoptosi dei condrociti articolari [25-29].
In diversi studi clinici, la Glucosamina e la Condroitina sono state associate ad altri principi attivi naturali che hanno prodotto risultati promettenti nel trattamento delle patologie su base infiammatoria: Si tratta del Metilsulfonilmetano (MSM) e della Boswellia serrata (BS) [30-32].
Il Metilsulfonilmetano (MSM) rappresenta la forma naturale dello zolfo organico [33]. L’azione protettiva
dell’MSM sulla cartilagine articolare, si deve al ruolo svolto dallo zolfo nella sintesi del Collagene; la presenza dello zolfo serve infatti a garantire la formazione dei legami disolfuro tra le triple eliche del Procollagene, promuovendo la formazione dei tessuti elastici quali appunto la cartilagine articolare. Il Metilsulfonilmetano inibisce inoltre l’attivazione delle MMPs ed è in grado di migliorare la permeabilità cellulare, permettendo alle sostanze dannose di essere eliminate più facilmente e prevenendo così un possibile aumento della pressione intracellulare che è causa di dolore e infiammazione. Il MSM inibisce infine la trasmissione dell’impulso doloroso attraverso le fibre nervose di tipo C e svolge una discreta azione antispasmodica, riducendo l’incidenza di dolore e crampi muscolari [34,35].
La Boswellia serrata, è un albero di grandi dimensioni che cresce nelle regioni montuose di India, Nord Africa e Medio Oriente. La gommoresina di questa pianta è ricca di numerosi principi attivi, tra cui spiccano per importanza gli Acidi cheto-boswellici (AKBA) [36]. Quest’ultimi sono in grado di inibire selettivamente l’enzima 5-Lipossigenasi, coinvolto nella biosintesi di importanti mediatori del processo infiammatorio: i
Leucotrieni. La selettività di inibizione relativa alla sola Lipossigenasi e non della Ciclossigenasi, rende l’azione antinfiammatoria degli Acidi Boswellici particolarmente interessante ed utile ai fini terapeutici, in quanto non determina in nessun caso gastrolesività (al contrario dei FANS). Gli Acidi boswellici si sono inoltre dimostrati in grado di bloccare la migrazione dei leucociti polimorfonucleati verso i siti di flogosi. Ciò fornisce un notevole vantaggio terapeutico, dal momento che, se non bloccate, queste cellule, una volta giunte sul sito dell’infiammazione, rilasciano una serie di enzimi ad azione proteolitica (Elastasi, Glucuronidasi, N- Acetilglucosaminidasi, ec..), responsabili della distruzione del collagene e dei tessuti elastici (Cartilagini, Tendini e Legamenti). Le proprietà della Boswellia Serrata sono ampiamente riconosciute in letteratura, al punto che lo stesso Ministero della Salute ha rilasciato per questa sostanza il seguente Claim Ministeriale: “La Boswellia Serrata Sostiene la Funzionalità Articolare e Contrasta gli Stati di Tensione localizzati” [37-40].
In conclusione, come si è visto, da un punto di vista teorico l’associazione della VS con HA, di breve durata e ad azione relativamente rapida sull’articolazione, con un trattamento condroprotettivo ad azione lenta che permetta di prolungare il beneficio clinico agendo sugli stessi meccanismi fisiopatologici potrebbe avere un fondato razionale clinico. In realtà, ambedue i tipi di trattamento hanno un effetto nel proteggere la cartilagine articolare e ritardare la progressione della malattia e la loro azione potrebbe essere complementare e sinergica [41-44].
Anche dal punto di vista clinico, l’associazione di una VS intrarticolare con 3-5 iniezioni intrarticolari di HA a cadenza settimanale con un trattamento condroprotettivo orale di 3-6 mesi, che permetta di prolungare il beneficio clinico agendo sugli stessi meccanismi fisiopatologici, sembra ragionevole e supportato da iniziali evidenze sperimentali.
Nuovi studi si rendono quindi necessari al fine di validare con ancor maggior vigore quanto precedentemente descritto.
Dott. Alessandro Cerino – Specialista in Ortopedia e Traumatologia
BIBLIOGRAFIA
- Felson DT. Epidemiology of hip and knee osteoarthritis. Epidemiol Rev. 1988;10:1-28. doi:
10.1093/oxfordjournals.epirev.a036019. PMID: 3066625. - Abramoff B, Caldera FE. Osteoarthritis: Pathology, Diagnosis, and Treatment Options. Med Clin North Am. 2020 Mar;104(2):293-311. doi: 10.1016/j.mcna.2019.10.007. Epub 2019 Dec 18. PMID:
32035570. - Xia B, Di Chen, Zhang J, Hu S, Jin H, Tong P. Osteoarthritis pathogenesis: a review of molecular
mechanisms. Calcif Tissue Int. 2014 Dec;95(6):495-505. doi: 10.1007/s00223-014-9917-9. Epub 2014 Oct 14. PMID: 25311420; PMCID: PMC4747051. - MacDonald Wood A, Brock TM, Heil K, Holmes R, Weusten A. A Review on the Management of Hip
and Knee Osteoarthritis. Int J Chronic Dis. 2013; 2013: 845015. - Kolasinski SL et al. 2019 American College of Rheumatology/Arthritis
Foundation Guideline for the Management of Osteoarthritis of the Hand, Hip, and Knee.
Arthritis Care & Research 2020. DOI 10.1002/acr.24131 - Gamble R., Wyeth-Ayerst J., Johnson E. L., Searle W. A., Beecham S. Recommendations for the
medical management of osteoarthritis of the hip and knee. Arthritis and
Rheumatism. 2000;43(9):1905–1915. - Glyn-Jones S, Palmer AJ, Agricola R, et al. Osteoarthritis. Lancet 2015;386:376-87.
- Primorac D, Molnar V, Matišić V, et al. Comprehensive review of knee osteoarthritis pharmacological
treatment and the latest professional societies’ guidelines. Pharmaceuticals (Basel) 2021;14:205. - du Souich P. Absorption, distribution and mechanism of action of SYSADOAS. Pharmacol Ther
2014;142:362-374. - Sukhikh S, Babich O, Prosekov A, et al. Future of chondroprotectors in the treatment of degenerative
processes of connective tissue. Pharmaceuticals (Basel) 2020;13:220. - Honvo G, Reginster JY, Rabenda V, et al. Safety of symptomatic slow-acting drugs for osteoarthritis:
outcomes of a systematic review and meta-analysis. Drugs Aging 2019;36(Suppl 1):65-99. - Irsay L, Borda I, Ileana M, et al. Effectiveness of glucosamine and chondroitin sulfate combination in
patients with primary osteoarthritis. Appl Med Inform 2010;27:47-54. - Balazs EA, Denlinger JL. Viscosupplementation: a new concept in the treatment of osteoarthritis. J
Rheumatol 1993;20(Suppl 39):3-9. - Ong KL, Runa M, Lau E, Altman R. Is Intra-Articular Injection of SynviscAssociated with a Delay to Knee Arthroplasty in Patients with Knee Osteoarthritis? Cartilage. 2018;
- Turajane T, Amphansap T, Labpiboonpong V, Maungsiri S.J. Total knee replacement following repeat
ed cycles of intra-articular sodiumhyaluronate (500-730 Kda) in failed conservative treatment of knee osteoarthritis: a 54-month follow-up. MedAssoc Thai. 2009 Dec;92 Suppl6:S63-8. - Bowman S, Awad ME, Hamrick MW, Hunter M, Fulzele S. Recent advances in hyaluronic acid based
therapy for osteoarthritis. Clin Transl Med. 2018;7(1):6. - Lazzaro F. Study on greater clinical efficacy of intra-articular injection therapy with hyaluronic acid
(mw ≥1000 KDa) for mild-to-moderate knee osteoarthritis combined with oral chondroprotection.
GIOT. 2013;39:96-103. - P.G. Mitchell, H.A. Magna, S.A. Yocum, et al., J. Clin. Invest. 97 (1996) 761–768.
- D.J. Shlopov, R.W. Lie, K.A. Hasty, et al., Arthritis Rheum. 40 (1997) 2065–2074.
- K. Imai, S. Ohta, T. Matsumoto, Y. Okada, Am. J. Pathol. 151 (1997) 245–256.
- S. Ohta, K. Imai, K. Yamashita, Y. Okada, Lab. Investig. 78 (1998) 79–87.
- Mehana EE, Khafaga AF, El-Blehi SS. The role of matrix metalloproteinases in osteoarthritis
pathogenesis: An updated review. Life Sci. 2019 Oct 1;234:116786. doi: 10.1016/j.lfs.2019.116786.
Epub 2019 Aug 22. PMID: 31445934. - Xie XW, Wan RZ, Liu ZP. Recent Research Advances in Selective Matrix Metalloproteinase-13
Inhibitors as Anti-Osteoarthritis Agents. ChemMedChem. 2017 Aug 8;12(15):1157-1168. doi:
10.1002/cmdc.201700349. Epub 2017 Jul 19. PMID: 28722301. - Mason V., Fratter A., Pellizzato M. Efficacy and absorption of hyaluronic acid and N-acetyl-D-
glucosamine for the treatment of osteoarthritis: a review. Nutrafoods (2018) 17:89-95. - Richy F, Bruyere O, Ethgen O, Cucherat M, Henrotin Y, Reginster JY. Structural and symptomatic
efficacy of glucosamine and chondroitin in knee osteoarthritis: a comprehensive meta-analysis. Arch
Intern Med. 2003;163:1514–22. - Glucosamine sulfate in the treatment of knee osteoarthritis symptoms: a randomized, double- blind,
placebo-controlled study using acetaminophen as a side comparator. Herrero-Beaumont G, Ivorra
JA, Del Carmen Trabado M, Blanco FJ, Benito P, Martín-Mola E, Paulino J, Marenco JL, Porto A, Laffon A, Araújo D, Figueroa M, Branco J Arthritis Rheum. 2007 Feb; 56(2):555-67. - Chondroprotective activity of N-acetylglucosamine in rabbits with experimental osteoarthritis.
Shikhman AR, Amiel D, D’Lima D, Hwang SB, Hu C, Xu A, Hashimoto S, Kobayashi K, Sasho T, Lotz MK Ann Rheum Dis. 2005 Jan; 64(1):89-94. - Structure-modifying effects of chondroitin sulfate in knee osteoarthritis: an updated meta- analysis
of randomized placebo-controlled trials of 2-year duration. Hochberg MC Osteoarthritis Cartilage.
2010 Jun; 18 Suppl 1():S28-31. - Chondroitin sulphate reduces both cartilage volume loss and bone marrow lesions in knee
osteoarthritis patients starting as early as 6 months after initiation of therapy: a randomised, double-blind, placebo-controlled pilot study using MRI. Wildi LM, Raynauld JP, Martel-Pelletier J, Beaulieu A, Bessette L, Morin F, Abram F, Dorais M, Pelletier JP Ann Rheum Dis. 2011 Jun; 70(6):982- 9. - Lubis AMT, Siagian C, Wonggokusuma E, Marsetyo AF, Setyohadi B. Comparison of Glucosamine-
Chondroitin Sulfate with and without Methylsulfonylmethane in Grade I-II Knee Osteoarthritis: A
Double Blind Randomized Controlled Trial. Acta Med Indones. 2017 Apr;49(2):105- 111. - Notarnicola A, Maccagnano G, Moretti L, et al. Methylsulfonylmethane and boswellic acids versus
glucosamine sulfate in the treatment of knee arthritis: Randomized trial. Int J Immunopathol
Pharmacol. 2016;29(1):140-146. - Usha, P.R., Naidu, M.U.R. Randomised, Double-Blind, Parallel, Placebo-Controlled Study of Oral
Glucosamine, Methylsulfonylmethane and their Combination in Osteoarthritis. Clin. Drug Investig.
24, 353–363 (2004). - Butawan M, Benjamin RL, Bloomer RJ. Methylsulfonylmethane: Applications and Safety of a Novel
Dietary Supplement. Nutrients. 2017;9(3):290. - Debbi EM, Agar G, Fichman G, Ziv YB, Kardosh R, Halperin N, Elbaz A, Beer Y, Debi R. Efficacy of
methylsulfonylmethane supplementation on osteoarthritis of the knee: a randomized controlled
study. BMC Complement Altern Med. 2011 Jun 27;11:50. - Kim LS, Axelrod LJ, Howard P, Buratovich N, Waters RF. Efficacy of methylsulfonylmethane (MSM) in
osteoarthritis pain of the knee: a pilot clinical trial. Osteoarthritis Cartilage. 2006 Mar;14(3):286-94. - Siddiqui MZ. Boswellia serrata, a potential antiinflammatory agent: an overview. Indian J Pharm Sci.
2011 May;73(3):255-61. doi: 10.4103/0250-474X.93507. PMID: 22457547; PMCID: PMC3309643. - Yu, G., Xiang, W., Zhang, T. et al. Effectiveness of Boswellia and Boswellia extract for osteoarthritis
patients: a systematic review and meta-analysis. BMC Complement Med Ther 20, 225 (2020). - Majeed M, Majeed S, Narayanan NK, Nagabhushanam K. A pilot, randomized, double-blind, placebo-
controlled trial to assess the safety and efficacy of a novel Boswellia serrata extract in the
management of osteoarthritis of the knee. Phytother Res. 2019 May;33(5):1457-1468. - Sontakke S, Thawani V, Pimpalkhute S, Kabra P, Babhulkar S, Hingorani L. Open, randomized,
controlled clinical trial of Boswellia serrata extract as compared to valdecoxib in osteoarthritis of
knee. Indian Journal of Pharmacology; Pondicherry Vol. 39, Fasc. 1, (Jan/Feb 2007): 27-29. - Kimmatkar N, Thawani V, Hingorani L, Khiyani R. Efficacy and tolerability of Boswellia serrata extract in treatment of osteoarthritis of knee–a randomized double blind placebo controlled trial.
Phytomedicine. 2003 Jan;10(1):3-7. - Bruyère O, Honvo G, Veronese N, et al. An updated algorithm recommendation for the management
of knee osteoarthritis from the European Society for Clinical and Economic Aspects of Osteoporosis,
Osteoarthritis and Musculoskeletal Diseases (ESCEO). Semin Arthritis Rheum 2019;49:337- 350. - Bruyere O, Pavelka K, Rovati LC, et al. Total joint replacement after glucosamine sulphate treatment
in knee osteoarthritis: results of a mean 8-year observation of patients from two previous 3-year,
randomised, placebo-controlled trials. Osteoarthritis Cartilage 2008;16:254-260. - Altman R, Lim S, Steen RG, Dasa V. Hyaluronic acid injections are associated with delay of total knee
replacement surgery in patients with knee osteoarthritis: evidence from a large U.S. health claims
database. PLoS One 2015;10:e0145776. - Ong KL, Anderson AF, Niazi F, et al. Hyaluronic acid injections in Medicare knee osteoarthritis patients are associated with longer time to knee arthroplasty. J Arthroplast 2016;31:1667- 1673.
MIGLIORAMENTO DEGLI INDICI CLINIMETRICI IN PAZIENTI CON ARTROSI DOPO IL TRATTAMENTO CON UN PRODOTTO A BASE DI N-ACETIL-D-GLUCOSAMINA, CONDOITIN SOLFATO, METILSULFONILMETANO (MSM), BOSWELLIA SERRATA, SILICE E VITAMINA C
by dott. Marco Tasso | 4 Marzo 2024 | Articoli | 0 Comments
L’osteoartrosi (OA) è una delle malattie croniche più diffuse e invalidanti che colpiscono gli adulti. La sua caratteristica più importante è la progressiva perdita di integrità della cartilagine articolare dovuta ad una maggiore azione catabolica del condrocita in combinazione con cambiamenti nelle ossa sottostanti e nei margini articolari [1] che provoca una compromissione del movimento articolare, un forte dolore e, in definitiva, la disabilità.
La sua elevata prevalenza e il suo impatto da moderato a grave sulla vita quotidiana pongono un significativo problema di salute pubblica [2].
Oggi, una cura per l’OA rimane sfuggente per cui, la sua gestione si concentra principalmente sull’attenuazione della sintomatologia associata. Le attuali raccomandazioni includono una combinazione di interventi non farmacologici come: la perdita di peso, programmi educativi, l’esercizio fisico e così via e farmacologici che precisamente riferiscono all’utilizzo di farmaci di natura differente come: paracetamolo, farmaci antinfiammatori non steroidei (FANS) e così via [3]. Tra questi, i FANS attualmente risultano essere quelli maggiormente prescritti [4] nonostante i documentati gravi affetti avversi associati al loro uso nel lungo termine.
In questo contesto, diventano necessari trattamenti alternativi sicuri ed efficaci, ma soprattutto si rafforza l’importanza della prevenzione il che si traduce, sempre più spesso, nell’impiego di nutraceutici ad azione condroprotettrice ed antinfiammatoria la cui composizione è per lo più rappresentata da molecole come le SYSADOA (SYmptomatic Slow-Acting Drugs) ovvero: N-Acetil-D-Glucosamina e Condroitin solfato [5-9] in combinazione con Metilsulfonilmetano e Boswellia serrata [9-15].
Con le premesse appena esposte, è stato condotto uno studio osservazionale in aperto monocentrico al fine di valutare l’impatto su alcuni indici clinimetrici dell’utilizzo di un integratore alimentare a base di N-Acetil-D-Glucosamina, Condoitin solfato, Metilsulfonilmetano (MSM), Boswellia serrata tit. al 65% in acidi boswellici, Silice e Vitamina C.
L’aggiunta in formulazione di attivi come il Biossido di Silicio e la Vitamina C è stata valutata in relazione a comprovate evidenze scientifiche [16-18] che hanno condotto alla costituzione di relativi claims EFSA.
I 30 pazienti (23 donne e 7 uomini) reclutati affetti da una condizione artrosica generalizzata con un’età mediadi 63 anni, hanno ricevuto il nutraceutico per un arco temporale di tre mesi.
La posologia prevedeva l’assunzione di una bustina al giorno (30 minuti dopo colazione o pranzo) ognuna delle quali conteneva i seguenti dosaggi:
| N-Acetil-D-Glucosamina | 500 mg |
| Condroitin solfato | 400 mg |
| Metilsulfonilmetano (MSM) | 2500 mg |
| Boswellia serrata e.s. tit. 65% in acidi boswellici (di cui acidi boswellici) | 300 mg (195 mg) |
| Silice | 20 mg |
| Vitamina C | 80mg (100% VNR) |
Il follow-up prevedeva una visita al basale corrispondente a T0 ed una seconda visita di controllo corrispondente a T1 a tre mesi dall’inizio del trattamento. Durante entrambe le visite, allo scopo di monitorare l’andamento della terapia, sono stati esaminati attraverso l’utilizzo di strumenti ben precisi, i seguenti endpoints:
- La riduzione del dolore articolare;
- La riduzione della rigidità articolare mattutina;
- La riduzione dell’indice di disabilità
Il dolore articolare è stato valutato mediante l’utilizzo della scala VAS (Visual Analogue Scale) [19] ovvero, uno dei parametri maggiormente impiegati per stimare l’intensità e l’entità di sollievo dello stesso nei pazienti adulti. Il dolore è un sintomo soggettivo, cioè percepito in modo differente da ciascun soggetto e soprattutto difficile da descrivere oltre che allo stesso modo complesso da percepire nella sua reale entità da parte di chi ascolta.
La scala VAS, pertanto, si dimostra lo strumento di valutazione ottimale a tale scopo in quanto è di semplice utilizzo, riproducibile, e rapido.
Ai pazienti è stato chiesto di valutare l’intensità del dolore provato nelle ultime 24 ore classificandolo con un punteggio da 0 a 10 dove 0 indicava intensità nulla e 10 intensità massima.
La rigidità articolare mattutina invece, è stata valutata su 4 livelli differenti:
- Nessuna;
- Lieve;
- Moderata;
- Severa.
Anche in questo caso si è richiesta una valutazione soggettiva da parte del paziente catalogando la rigidità articolare percepita appena svegli in una delle sopraelencate categorie.
Infine, l’Health Assessment Questionnaire (HAQ) è stato lo strumento utilizzato per la valutazione dell’indice di disabilità [20].
Nello specifico, con HAQ si fa riferimento ad una misurazione della capacità funzionale, rapido e facile da calcolare utile nel valutare la risposta a breve termine al trattamento.
L’HAQ che regolarmente comprende 20 quesiti riguardanti attività della vita quotidiana, suddivisi in 8 categorie (lavarsi e vestirsi, alzarsi, camminare, igiene personale, mangiare, raggiungere ed afferrare oggetti, attività più complesse), è stato ridotto ad 8 quesiti ognuno rappresentativo di una singola categoria. Le risposte possibili per ogni quesito erano 4, in relazione al grado di difficoltà che comportava l’azione richiesta:
- 0 = senza difficoltà
- 1 = con qualche difficoltà
- 2 = con molta difficoltà
- 3 = non possibile
La somma dei punteggi (da 0 a 24) diviso 8, rappresentava il punteggio finale dell’HAQ.
Definiti i materiali e metodi utilizzati, possiamo passare all’analisi dei risultati.
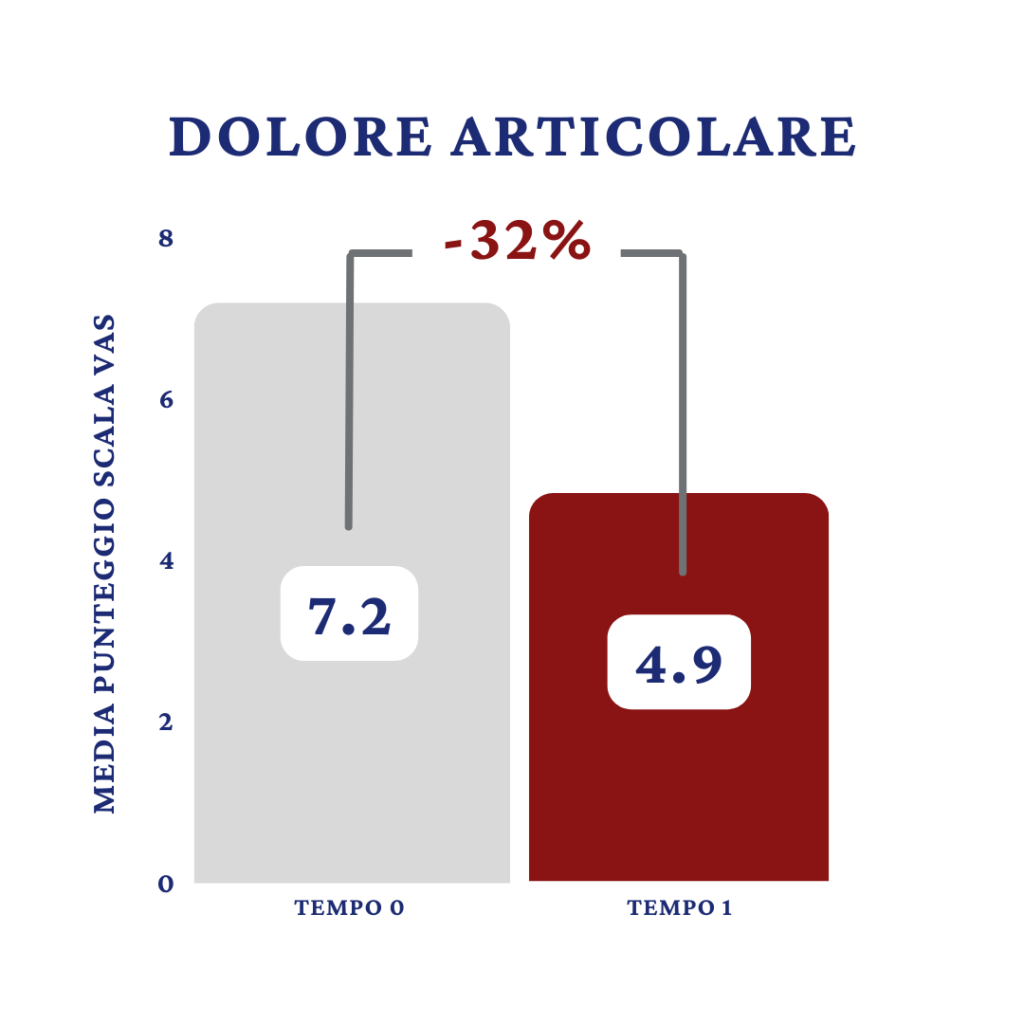
Gli esiti sull’indice di dolorabilità ottenuti (Fig.1), hanno evidenziato che la media del punteggio della scala VAS è passato da 7,2 al basale (T0) a 4,9 al controllo (T1) assistendo così ad una riduzione percentuale del valore medio del 32%.
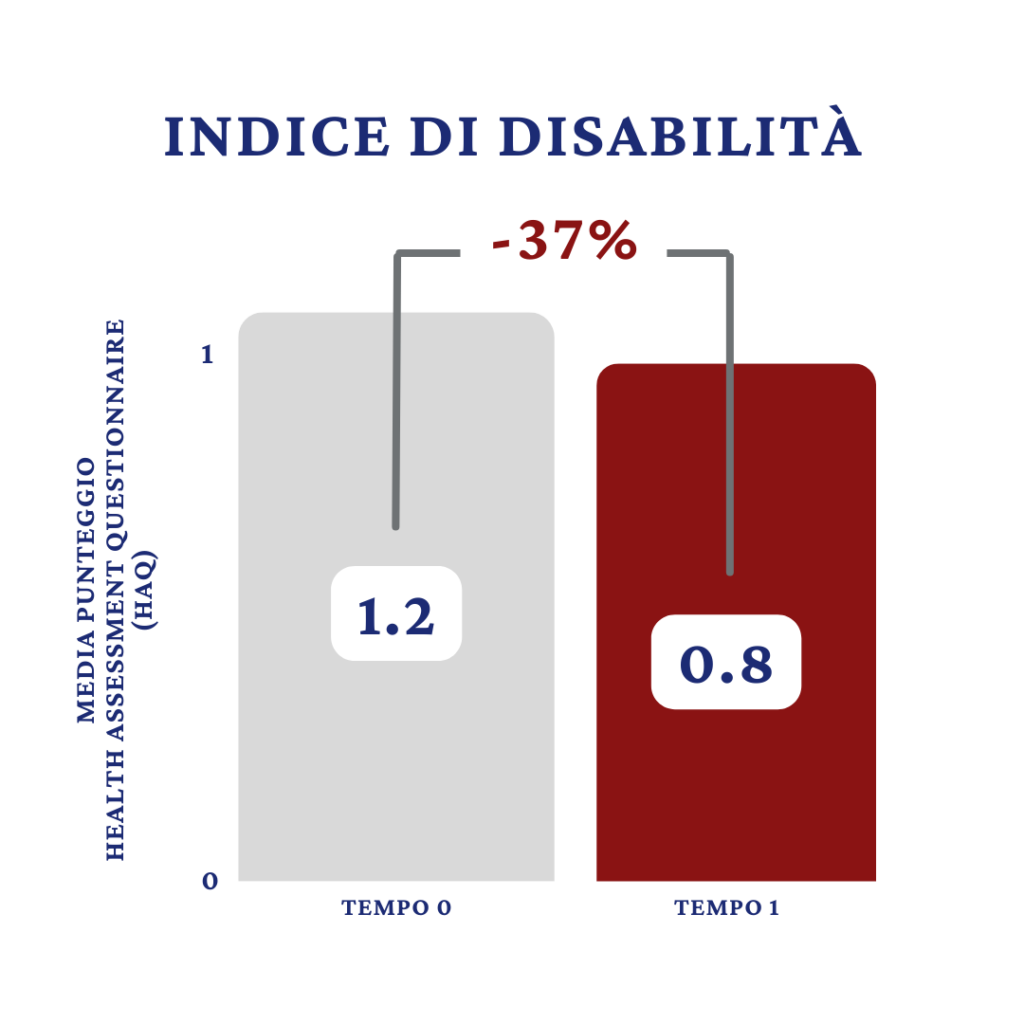
Anche la media del punteggio HAQ ha subito una variazione (Fig.2) tra Il basale (T0) ed il controllo (T1). Più precisamente, si è passati da un valore di 1,2 a T0 ad uno di 0,8 a T1 il che si traduce con una riduzione percentuale del valore medio pari al 37%
L’ultimo endpoint esaminato è stato quello della rigidità articolare mattutina (Fig.3). I 30 pazienti valutati al basale (T0) avevano una distribuzione per categoria pari a:
- 2 con assenza di rigidità
- 12 con rigidità lieve
- 14 con rigidità moderata
- 2 con rigidità severa
Al controllo (T1) si è assistito ad una ridistribuzione delle categorie così come segue:
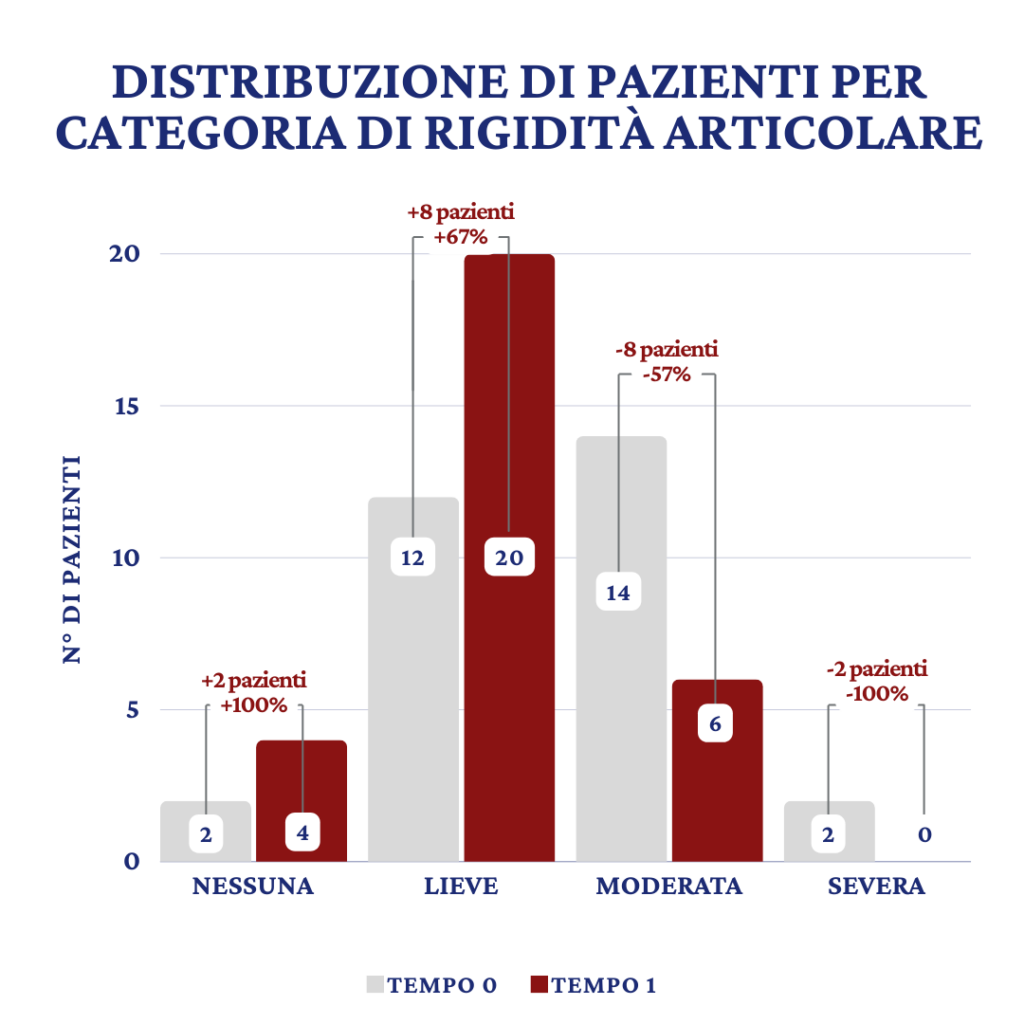
- 4 con assenza di rigidità
- 20 con rigidità lieve
- 6 con rigidità moderata
- 0 con rigidità severa
l risultato ottenuto, indica una variazione percentuale vantaggiosa dei pazienti all’interno della stessa categoria tra il basale (T0) ed il controllo (T1) in quanto, a conclusione del periodo di trattamento, gran parte dei pazienti in studio presentavano una rigidità articolare mattutina assente o lieve.
La ridistribuzione positiva della popolazione esaminata nelle categorie di rigidità può essere facilmente compresa anche dai dati percentuali evidenziabili in Fig. 4.
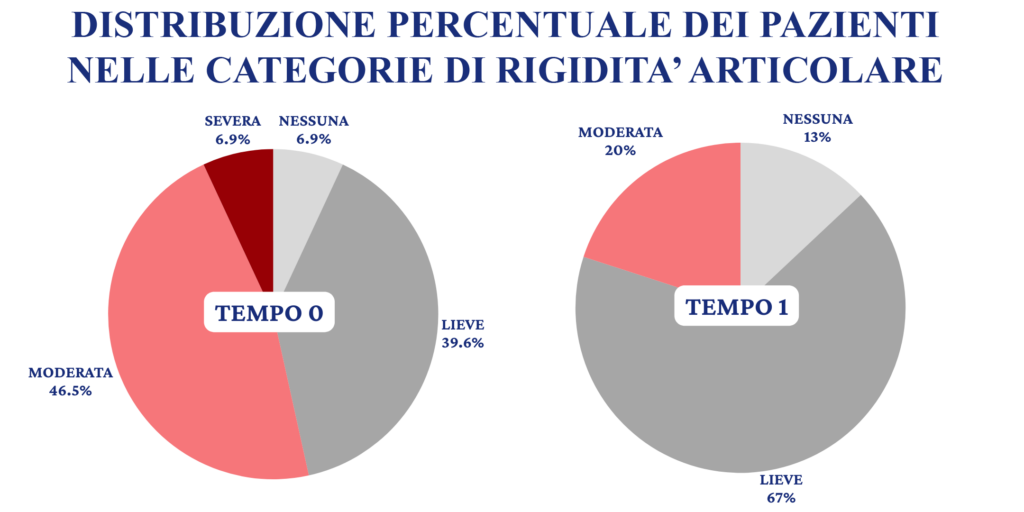
È constatabile come i pazienti con una rigidità articolare mattutina riferita tra l’assente ed il lieve raggiunga un valore del 79% sul totale dei pazienti esaminati al controllo (T1) rispetto al 47% del basale (T0).
In conclusione, l’utilizzo trimestrale di un integratore a base di N-Acetil-D-Glucosamina, Condoitin solfato, Metilsulfonilmetano (MSM), Boswellia serrata tit. al 65% in acidi boswellici, Silice e Vitamina C ha avuto un impatto positivo sulla riduzione del dolore articolare, sulla riduzione della rigidità articolare mattutina e sulla riduzione dell’indice di disabilità dei pazienti esaminati.
I risultati del presente studio osservazionale sommati alle numerose e promettenti basi scientifiche pongono l’accento sulla possibilità che la supplementazione nutrizionale rappresenti un’importante alternativa terapeutica per la gestione dell’ostoartrosi (soprattutto in tema di prevenzione) od una valida terapia di associazione al classico trattamento farmacologico.
La necessità di approfondire ulteriormente l’argomento con studi clinici randomizzati e controllati è però fondamentale al fine di indagare con maggiore cura ed eventualmente confutare con dati ancor più concreti i potenziali benefici del trattamento combinato di questi principi attivi nella patologia osteoartrosica.
Dott. Marco Tasso – Specialista in Ortopedia e Traumatologia
BIBLIOGRAFIA
- Suri P, Morgenroth DC, Hunter DJ. Epidemiology of osteoarthritis and associated comorbidities. PMR. 2012 May;4(5 Suppl):S10-9. doi: 10.1016/j.pmrj.2012.01.007. PMID: 22632687.
- Yelin E. The economics of osteoarthritis. In: Brandt KD, Doherty M, Lohmander LS, editor. Osteoarthritis. Oxford: Oxford University Press; 2003. pp. 17–21.
- Jordan KM, Arden NK, Doherty M, Bannwarth B, Bijlsma JW, Dieppe P, Gunther K, Hauselmann H, Herrero-Beaumont G, Kaklamanis P, et al. EULAR Recommendations 2003: an evidence based approach to the management of knee osteoarthritis: Report of a Task Force of the Standing Committee for International Clinical Studies Including Therapeutic Trials (ESCISIT) Ann Rheum Dis. 2003;62:1145–1155. doi: 10.1136/ard.2003.011742.
- Abramson SB. The role of NSAIDs in the treatment of osteoarthritis. In: Brandt KD, Doherty M, Lohmander LS, editor. Osteoarthritis. Oxford: Oxford University Press; 2003. pp. 251–258.
- Honvo G, Reginster JY, Rabenda V, Geerinck A, Mkinsi O, Charles A, Rizzoli R, Cooper C, Avouac B, Bruyère O. Safety of Symptomatic Slow-Acting Drugs for Osteoarthritis: Outcomes of a Systematic Review and Meta-Analysis. Drugs Aging. 2019 Apr;36(Suppl 1):65-99. doi: 10.1007/s40266-019-00662-z. PMID: 31073924; PMCID: PMC6509099.
- Rubin BR, Talent JM, Kongtawelert P, Pertusi RM, Forman MD, Gracy RW. Oral polymeric N-acetyl-D-glucosamine and osteoarthritis. J Am Osteopath Assoc. 2001 Jun;101(6):339-44. PMID: 11432083.
- Pecchi E, Priam S, Mladenovic Z, Gosset M, Saurel AS, Aguilar L, Berenbaum F, Jacques C. A potential role of chondroitin sulfate on bone in osteoarthritis: inhibition of prostaglandin E₂ and matrix metalloproteinases synthesis in interleukin-1β-stimulated osteoblasts. Osteoarthritis Cartilage. 2012 Feb;20(2):127-35. doi: 10.1016/j.joca.2011.12.002. Epub 2011 Dec 11. PMID: 22179028.
- Henrotin Y, Lambert C. Chondroitin and glucosamine in the management of osteoarthritis: an update. Curr Rheumatol Rep. 2013 Oct;15(10):361. doi: 10.1007/s11926-013-0361-z. PMID: 23955063.
- Stuber K, Sajko S, Kristmanson K. Efficacy of glucosamine, chondroitin, and methylsulfonylmethane for spinal degenerative joint disease and degenerative disc disease: a systematic review. J Can Chiropr Assoc. 2011 Mar;55(1):47-55. PMID: 21403782; PMCID: PMC3044807.
- Notarnicola A, Maccagnano G, Moretti L, et al. Methylsulfonylmethane and boswellic acids versus glucosamine sulfate in the treatment of knee arthritis: Randomized trial. Int J Immunopathol Pharmacol. 2016;29(1):140-146.
- Usha, P.R., Naidu, M.U.R. Randomised, Double-Blind, Parallel, Placebo-Controlled Study of Oral Glucosamine, Methylsulfonylmethane and their Combination in Osteoarthritis. Clin. Drug Investig. 24, 353–363 (2004).
- Yu, G., Xiang, W., Zhang, T. et al. Effectiveness of Boswellia and Boswellia extract for osteoarthritis patients: a systematic review and meta-analysis. BMC Complement Med Ther 20, 225 (2020).
- Majeed M, Majeed S, Narayanan NK, Nagabhushanam K. A pilot, randomized, double-blind, placebo-controlled trial to assess the safety and efficacy of a novel Boswellia serrata extract in the management of osteoarthritis of the knee. Phytother Res. 2019 May;33(5):1457-1468.
- Sontakke S, Thawani V, Pimpalkhute S, Kabra P, Babhulkar S, Hingorani L. Open, randomized, controlled clinical trial of Boswellia serrata extract as compared to valdecoxib in osteoarthritis of knee. Indian Journal of Pharmacology; Pondicherry Vol. 39, Fasc. 1, (Jan/Feb 2007): 27-29.
- Kimmatkar N, Thawani V, Hingorani L, Khiyani R. Efficacy and tolerability of Boswellia serrata extract in treatment of osteoarthritis of knee–a randomized double blind placebo controlled trial. Phytomedicine.
- Murad S, Grove D, Lindberg KA, Reynolds G, Sivarajah A, Pinnell SR. Regulation of collagen synthesis by ascorbic acid. Proc Natl Acad Sci U S A. 1981 May;78(5):2879-82. doi: 10.1073/pnas.78.5.2879. PMID: 6265920; PMCID: PMC319462.
- Pinnell SR. Regulation of collagen biosynthesis by ascorbic acid: a review. Yale J Biol Med. 1985 Nov-Dec; 58(6):553-9. PMID: 3008449; PMCID: PMC2589959.
- 18. Jugdaohsingh R. Silicon and bone health. J Nutr Health Aging. 2007 Mar-Apr;11(2):99-110. PMID: 17435952; PMCID: PMC2658806.
- Williamson A, Hoggart B. Pain: a review of three commonly used pain rating scales. J Clin Nurs. 2005 Aug;14(7):798-804. doi: 10.1111/j.1365-2702.2005.01121.x. PMID: 16000093.
- Wylde V, Livesey C, Learmonth ID, Blom AW, Hewlett S. Evaluation of the Personal Impact Health Assessment Questionnaire (PI HAQ) to capture the impact of disability in osteoarthritis. Musculoskeletal Care. 2010 Jun;8(2):87-98. doi: 10.1002/msc.170. PMID: 20232480.
L’IMPIEGO DI ATTIVI NATURALI NELLA GESTIONE DEL PAZIENTE GONARTROSICO
by Dott. Raffaele Franzese | 15 Febbraio 2024 | Articoli | 0 Comments
L’ Osteoartrosi (OA) rappresenta, ad oggi, la patologia reumatica più diffusa nella popolazione mondiale: un terzo della popolazione superiore ai 45 anni è alla ricerca costante di un trattamento per l’OA e, l’81% di questi, lamenta dolore e importanti limitazioni funzionali, con conseguente difficoltà di svolgimento delle normali attività quotidiane e astensione dai luoghi di lavoro [1].
Con il progressivo invecchiamento della popolazione e l’aumento sempre più consistente dell’obesità, l’incidenza di OA sintomatica e di protesi articolari aumenta di anno in anno, così come i costi sociali e sanitari, divenuti sempre più insostenibili.
Come se non bastasse, sempre più frequentemente, si registrano segni di artrosi in soggetti giovani che praticano sport ad alta intensità o sottoposti ad un lavoro fisico usurante e per i quali l’artoplastica articolare non rappresenta ancora una strada percorribile [1].
L’artrosi si configura quindi sempre più come una malattia sociale, non necessariamente confinata alla sfera geriatrica, facendo emergere un chiaro e crescente bisogno di nuove soluzioni terapeutiche.
Tutte le strutture articolari dell’organismo possono essere colpite da fenomeni artrosici, ma attualmente, la gonartrosi rappresenta, insieme all’osteoartrosi dell’anca, la forma artrosica responsabile della maggiore disabilità e dei maggiori costi sociali, calcolati in termini di giorni di assenza da lavoro e pensionamento anticipato [2].
La gonartrosi colpisce specificatamente la cartilagine dell’articolazione del ginocchio. Il tessuto si deteriora portando allo sfregamento diretto delle ossa dell’articolazione e provocando dolore, difficoltà nel movimento e infiammazione [2].
Le raccomandazioni della SIR (Italian Society for Rheumatology), aggiornate al 2019, caldeggiano un approccio multidisciplinare al trattamento della gonartrosi, incentrato sull’adozione di terapie farmacologiche, riabilitative e su un corretto stile di vita [3]. Sul piano delle terapie farmacologiche, nei pazienti in cui il dolore non è adeguatamente controllato, l’analgesia di prima linea si basa sul ricorso ai FANS, agli Analgesici oppioidi e alle iniezioni intra-articolari di Corticosteoridi [1]. Tuttavia, anche il migliore di questi agenti, fornisce un’efficacia clinicamente significativa solo nella metà dei soggetti; inoltre, gli effetti collaterali e la potenziale tossicità, ne limitano l’impiego in una popolazione che spesso ha associate comorbidità [1].
Nei pazienti con gonartrosi refrattari alle terapie conservative o che non abbiano risposto alle terapie farmacologiche, per ridurre il dolore e la flogosi, prima del trattamento chirurgico, è possibile prendere in considerazione la somministrazione intra-articolare di Acido ialuronico [4].
Sebbene l’uso di questi device migliori taluni parametri clinici (dolore, scrosci articolari, etc.) i risultati rimangono ambigui per quanto riguarda il controllo delle altre componenti dell’osteoartrosi, particolarmente l’infiammazione e la rigenerazione cartilaginea [5-7]. Per incrementare il successo terapeutico della terapia farmacologia e viscosupplementativa è possibile ricorrere alla medicina integrata.
Ben riconosciuta dalla comunità scientifica, la medicina integrata prevede l’utilizzo di integratori e nutraceutici, sia nella prevenzione che nella gestione di fondo della gonartrosi. Ne sono un esempio i cosiddetti SYSADOA (SYmptomatic Slow-Acting Drugs), ovvero principi attivi in grado di favorire i processi riparativi cartilaginei, ritardando/stabilizzando i cambiamenti patologici a carico dell’articolazione [8].
Negli ultimi anni poi la medicina d’integrazione si sta sempre più orientando verso l’impiego di principi attivi, naturali e/o endogeni che, oltre a fornire supporto trofico all’articolazione, siano in grado di operare
l’inibizione delle cosiddette metalloproteasi di matrice (MMPs), enzimi endogeni responsabili della degenerazione cartilaginea e del conseguente processo infiammatorio [9]. In questo modo è possibile agire direttamente a monte del processo patogenetico con un duplice meccanismo: di supporto e antiflogistico.
Appartengono alle categorie sopracitate:
- La N-Acetil-D-glucosammina;
- La Condroitina solfato;
- Il Metilsulfonilmetano;
- La Boswellia serrata.
La N-Acetil-D-Glucosamina (NAG) è un derivato N-acetilato della glucosamina, presente naturalmente nell’organismo umano e sintetizzata a partire dalla D-glucosamina-6-P [10]. Estratta solitamente dai tessuti che strutturano il carapace dei crostacei, interviene nella sintesi di molecole biologicamente molto preziose quali: Glicosaminoglicani (GAG), Proteoglicani e Acido Ialuronico (azione anabolica) ovvero macromolecole, presenti nella matrice cartilaginea e/o nella sinovia, che concorrono al mantenimento delle proprietà strutturali e funzionali dei tessuti sottoposti a continue sollecitazioni, come quelli articolari.
In quanto condroprotettore, oltre che a svolgere un’azione anabolica sul condrocita, è attiva anche nella riduzione dell’attività della Collagenasi, enzima condrolitico appartenente alla classe delle MMPs, responsabile della degradazione del collagene (azione catabolica).
La Condroitina Solfato invece, rappresenta il GAG più abbondante a livello della cartilagine articolare ed è composto da una catena, di lunghezza variabile, rappresentata da due zuccheri alternati: N-Acetilgalattosamina e l’Acido glucuronico. È un elemento fondamentale della matrice cartilaginea, in quanto interviene in diversi processi che contribuiscono alla conservazione della sua struttura ed al mantenimento delle sue caratteristiche funzionali [11].
Studi clinici hanno dimostrato che Glucosamina e Condroitin solfano possano essere utilizzati in combinazione ottenendo un’efficacia superiore nella gestione dell’artrosi al ginocchio [12-16] rispetto all’utilizzo della singola molecola, ma anche che, l’associazione di questi condroprotettori con principi attivi naturali ad azione antinfiammatoria come il Metilsulfonilmetano (MSM) e la Boswellia serrata (BS) [17-20], possa essere altrettanto vantaggiosa.
Il Metilsulfonilmetano (MSM) è la forma naturale dello zolfo organico [18]. L’azione protettiva dell’MSM sulla cartilagine articolare, si deve al ruolo svolto dallo zolfo nella sintesi del Collagene, ma anche all’azione di inibizione delle MMPs. È inoltre in grado di migliorare la permeabilità delle membrane cellulari: favorendo l’eliminazione di agenti ossidanti e prodotti di scarto metabolico, si evita il loro accumulo all’interno della cellula, prevenendo/contrastando così l’insorgenza di eventuali focolai infiammatori, soprattutto a livello articolare, muscolare e del connettivo. Infine, il MSM inibisce la trasmissione dell’impulso doloroso attraverso le fibre nervose di tipo C e svolge una discreta azione antispasmodica, riducendo l’incidenza di dolore e crampi muscolari [21, 22].
La Boswellia serrata invece, è un albero di grandi dimensioni la cui gommoresina è caratterizzata dalla presenza di costituenti attivi, tra cui spiccano per importanza gli Acidi cheto-boswellici (AKBA) [23] i quali, sono in grado di inibire selettivamente l’enzima 5-Lipossigenasi, coinvolto nella biosintesi di importanti mediatori del processo infiammatorio: i Leucotrieni. La selettività di inibizione relativa alla sola Lipossigenasi e non della Ciclossigenasi, garantisce un’efficace azione antinfiammatoria, senza determinare in nessun caso gastrolesività, consentendone l’impiego anche per periodi di tempo prolungati e in pazienti nei quali l’uso prolungato di FANS è controindicato (esp. pazienti diabetici) [24-27].
Alla luce di quanto esposto in tema di gestione del paziente gonartrosico, la parola chiave fondamentale diventa “SINERGIA”. Le numerose evidenze scientifiche hanno infatti dimostrato che gli estratti fitoterapici, nel loro complesso, offrono risultati migliori rispetto alle dosi equivalenti di singoli principi attivi [28].
In conclusione, l’impiego di questi principi attivi, congiuntamente alla terapia farmacologica, alle misure riabilitative e ad uno stile di vita sano, consentono al clinico di offrire al proprio paziente un regime terapeutico più maneggevole e tollerabile nel medio-lungo periodo, incrementando il successo terapeutico e migliorandone la qualità di vita.
Dott. Raffaele Franzese – Specialista in Ortopedia e Traumatologia
BIBLIOGRAFIA
- Watt FE, Gulati M. New Drug Treatments for Osteoarthritis: What is on the Horizon? Eur Med J Rheumatol. 2017 Mar 2; 2(1): 50–58.
- MacDonald Wood A, Brock TM, Heil K, Holmes R, Weusten A. A Review on the Management of Hip and Knee Osteoarthritis. Int J Chronic Dis. 2013; 2013: 845015.
- Ariani A, Manara M, Fioravanti A, Iannone F, Salaffi F, Ughi N, Prevete I, Bortoluzzi A, Parisi S, Scirè CA. The Italian Society for Rheumatology clinical practice guidelines for the diagnosis and management of knee, hip and hand osteoarthritis. Reumatismo. 2019 Sep 23;71(S1):5-21. doi: 10.4081/reumatismo.2019.1188. PMID: 31948191.
- The intra-articular viscosupplementation with polydeoxyribonucleotides. The new option to ameliorate clinical response. Trends Med 2010: 10 (4):183-190.
- Divine JG, Zazulak BT, Hewett TE. Viscosupplementation for knee osteoarthritis: a systematic review. Clin Orthop Relat Res 2007; 455:113-122.
- Dagenais S. Intra-articular hyaluronic acid (viscosupplementation) for knee osteoarthritis. Issues Emerg Health Technol 2006; 94:1-4.
- Espallargues M, Pons JM. Efficacy and safety of viscosupplementation with Hylan G-F 20 for the treatment of knee osteoarthritis: a systematic review. Int J Technol Assess Health Care 2003; 19:41-56.
- Bruyère O, Burlet N, Delmas PD, Rizzoli R, Cooper C, Reginster JY. Evaluation of symptomatic slow-acting drugs in osteoarthritis using the GRADE system. BMC Musculoskelet Disord. 2008 Dec 16;9:165.
- Burrage PS, Mix KS, Brinckerhoff CE. Matrix metalloproteinases: role in arthritis. Front Biosci. 2006 Jan 1;11:529-43.
- Mason V., Fratter A., Pellizzato M. Efficacy and absorption of hyaluronic acid and N-acetyl-D-glucosamine for the treatment of osteoarthritis: a review. Nutrafoods (2018) 17:89-95.
- Rojas-Briones V, Harrison-Muñoz S, Irarrázaval S. Is chondroitin sulfate effective for osteoarthritis? Medwave. 2017 Apr 26;17(Suppl2):e6929. Spanish, English. doi: 10.5867/medwave.2017.6929. PMID: 28452976.
- Richy F, Bruyere O, Ethgen O, Cucherat M, Henrotin Y, Reginster JY. Structural and symptomatic efficacy of glucosamine and chondroitin in knee osteoarthritis: a comprehensive meta-analysis. Arch Intern Med. 2003;163:1514–22.
- Glucosamine sulfate in the treatment of knee osteoarthritis symptoms: a randomized, double- blind, placebo-controlled study using acetaminophen as a side comparator. Herrero-Beaumont G, Ivorra JA, Del Carmen Trabado M, Blanco FJ, Benito P, Martín-Mola E, Paulino J, Marenco JL, Porto A, Laffon A, Araújo D, Figueroa M, Branco J Arthritis Rheum. 2007 Feb; 56(2):555-67.
- Chondroprotective activity of N-acetylglucosamine in rabbits with experimental osteoarthritis. Shikhman AR, Amiel D, D’Lima D, Hwang SB, Hu C, Xu A, Hashimoto S, Kobayashi K, Sasho T, Lotz MK Ann Rheum Dis. 2005 Jan; 64(1):89-94.
- Structure-modifying effects of chondroitin sulfate in knee osteoarthritis: an updated meta- analysis of randomized placebo-controlled trials of 2-year duration. Hochberg MC Osteoarthritis Cartilage. 2010 Jun; 18 Suppl 1():S28-31.
- Chondroitin sulphate reduces both cartilage volume loss and bone marrow lesions in knee osteoarthritis patients starting as early as 6 months after initiation of therapy: a randomised, double- blind, placebo-controlled pilot study using MRI. Wildi LM, Raynauld JP, Martel-Pelletier J, Beaulieu A,Bessette L, Morin F, Abram F, Dorais M, Pelletier JP Ann Rheum Dis. 2011 Jun; 70(6):982- 9
- Lubis AMT, Siagian C, Wonggokusuma E, Marsetyo AF, Setyohadi B. Comparison of Glucosamine-Chondroitin Sulfate with and without Methylsulfonylmethane in Grade I-II Knee Osteoarthritis: A Double Blind Randomized Controlled Trial. Acta Med Indones. 2017 Apr;49(2):105- 111.
- Notarnicola A, Maccagnano G, Moretti L, et al. Methylsulfonylmethane and boswellic acids versus glucosamine sulfate in the treatment of knee arthritis: Randomized trial. Int J Immunopathol Pharmacol. 2016;29(1):140-146.
- Usha, P.R., Naidu, M.U.R. Randomised, Double-Blind, Parallel, Placebo-Controlled Study of Oral Glucosamine, Methylsulfonylmethane and their Combination in Osteoarthritis. Clin. Drug Investig. 24, 353–363 (2004).
- Butawan M, Benjamin RL, Bloomer RJ. Methylsulfonylmethane: Applications and Safety of a Novel Dietary Supplement. Nutrients. 2017;9(3):290.
- Debbi EM, Agar G, Fichman G, Ziv YB, Kardosh R, Halperin N, Elbaz A, Beer Y, Debi R. Efficacy of methylsulfonylmethane supplementation on osteoarthritis of the knee: a randomized controlled study. BMC Complement Altern Med. 2011 Jun 27;11:50.
- Kim LS, Axelrod LJ, Howard P, Buratovich N, Waters RF. Efficacy of methylsulfonylmethane (MSM) in osteoarthritis pain of the knee: a pilot clinical trial. Osteoarthritis Cartilage. 2006 Mar;14(3):286-94.
- Siddiqui MZ. Boswellia serrata, a potential antiinflammatory agent: an overview. Indian J Pharm Sci. 2011 May;73(3):255-61. doi: 10.4103/0250-474X.93507. PMID: 22457547; PMCID: PMC3309643.
- Yu, G., Xiang, W., Zhang, T. et al. Effectiveness of Boswellia and Boswellia extract for osteoarthritis patients: a systematic review and meta-analysis. BMC Complement Med Ther 20, 225 (2020).
- Majeed M, Majeed S, Narayanan NK, Nagabhushanam K. A pilot, randomized, double-blind, placebo-controlled trial to assess the safety and efficacy of a novel Boswellia serrata extract in the management of osteoarthritis of the knee. Phytother Res. 2019 May;33(5):1457-1468.
- Sontakke S, Thawani V, Pimpalkhute S, Kabra P, Babhulkar S, Hingorani L. Open, randomized, controlled clinical trial of Boswellia serrata extract as compared to valdecoxib in osteoarthritis of knee. Indian Journal of Pharmacology; Pondicherry Vol. 39, Fasc. 1, (Jan/Feb 2007): 27-29.
- Kimmatkar N, Thawani V, Hingorani L, Khiyani R. Efficacy and tolerability of Boswellia serrata extract in treatment of osteoarthritis of knee–a randomized double blind placebo controlled trial. Phytomedicine. 2003 Jan;10(1):3-7.24. http://www.salute.gov.it/portale/temi/p2_6.jsp?id=1424&area=Alimenti%20particolari%20e%20integratori&menu=integratori
- Spinella M. The importance of pharmacological synergy in psychoactive herbal medicines. Altern Med Rev. 2002 Apr;7(2):130-7.

IMPIEGO DEI NUTRACEUTICI NEL TRATTAMENTO CRONICO DEI PAZIENTI FIBROMIALGICI
by Dott. Pasquale Cozzolino | 2 Gennaio 2024 | Articoli | 0 Comments
La sindrome fibromialgica è un comune disturbo rappresentato da un dolore cronico e diffuso[1] la cui prevalenza è stata fissata da una recente revisione di tutta la letteratura al 2.7% della popolazione mondiale: il 4.2% delle donne ed l’1.3% degli uomini con un rapporto maschi-femmine di 1:3[2].
Il termine fibromialgia significa dolore nei muscoli e nelle strutture connettivali fibrose (i legamenti e i tendini) e viene definita “sindrome” poiché esistono segni e sintomi clinici che sono contemporaneamente presenti.
È infatti spesso una patologia complessa da diagnosticare dal momento che alcuni dei suoi sintomi possono essere riscontrati anche in altre condizioni cliniche.
Sebbene possa assomigliare ad una patologia articolare, non si tratta di artrite e non causa deformità delle strutture articolari. È in effetti una forma di reumatismo extra-articolare o dei tessuti molli, ma manca di alterazioni di laboratorio.
Per molti anni la difficoltà nella gestione del paziente fibromialgico ha condotto gli esperti a considerare la sintomatologia riferita e ad essa associata come immaginaria o non importante. Negli ultimi 10 anni, tuttavia, studi[3-5] hanno dimostrato che certi sintomi, come il dolore muscolo scheletrico diffuso, e la presenza di specifiche aree algogene alla digitopressione (tender points) sono presenti nei pazienti affetti da sindrome fibromialgica e non comunemente nelle persone sane o in pazienti affetti da altre patologie reumatiche dolorose.
La causa della fibromialgia non è attualmente nota, ma ad oggi ricerche hanno permesso di confutare la visione obsoleta di condizione psicogena[5] e di caratterizzarla come un disturbo della regolazione del dolore e della sensibilizzazione centrale[6,7], la cui sintomatologia associata può subire peggioramenti a causa di alcuni fattori esterni come ad esempio, stress (eventi stressanti, traumi, lutti) affaticamento (per lavoro), carenza di sonno, rumore, freddo, umidità, cambiamenti meteorologici e periodo pre-mestruale[9].
Il processo di analisi e studio della patologia è stato determinante in quanto ha consentito la definizione e la fissazione di linee guida per la sua diagnosi[9,10].
Ciò nonostante, la difficoltà diagnostica è però ancora oggi l’ostacolo principale della fibromialgia, ma è importante specificare che non rappresenta l’unico intralcio ad essa associato. La gestione del paziente dal punto di vista del trattamento farmacologico da parte del clinico è infatti altrettanto complessa. Non è insolito che i pazienti disorientati si rivolgano ad almeno quattro tipologie di medico differenti (reumatologo, fisiatra, neurologo, ortopedico) esponendosi conseguenzialmente a terapie che prevedono l’utilizzo di farmaci di natura molteplice[11] i quali mirano ad agire selettivamente sulle diverse aree di interesse.
Gli antidepressivi, gli oppioidi, i FANS, i sedativi, i miorilassanti e gli antiepilettici sono infatti solo alcuni dei numerosi farmaci che vengono utilizzati per il trattamento della patologia[12] e molto frequentemente non risolvono alcuna delle manifestazioni cliniche traducendosi in un esito terapeutico insoddisfacente.
Questa tipologia di approccio è inoltre associata a limitazioni in termini di tollerabilità[13] a principi attivi non immuni ad una quantità massiva di effetti collaterali.
Pertanto, particolarmente interessante è l’approccio nutraceutico in associazione a quello farmacologico od in alternativa allo stesso con lo scopo di agire sugli svariati sintomi della patologia senza però esporre il paziente ad effetti collaterali anche gravi.
A tal fine vengono proposti principi attivi come ad esempio: la Boswellia Serrata, il Magnesio e l’L-Triptofano.
L’acido 11-cheto-beta-boswellico (AKBA) nello specifico, particolarmente presente nella gommoresina della Boswellia Serrata[14], agisce inibendo selettivamente un enzima, la 5-lipossigenasi, impedendo con ciò la sintesi dei leucotrieni: i mediatori chimici che inducono il processo infiammatorio sia acuto che cronico.
La selettività di inibizione relativa alla sola lipossigenasi e non alle ciclossigenasi, rende l’azione antinfiammatoria degli acidi boswellici particolarmente interessante ed utile, in quanto non determina in nessun caso gastrolesività[15] rendendo così l’attivo un’alternativa estremamente valida ai FANS.
Tale azione ampiamente documentata nella letteratura scientifica permette l’utilizzo del botanical nel lungo termine al fine di trattare il sintomo del dolore cronico e contrastare gli stati di tensione localizzati (Claim Ministeriale).
Il paziente fibromialgico è un paziente che come già chiarito in precedenza patisce dolore diffuso di varia intensità, ma un altro sintomo particolarmente presente in questa condizione clinica è anche quello della rigidità muscolare soprattutto in aree come quella di spalle, schiena, zona lombare e glutei[16]. Questo tipo di sintomatologia può essere contrastata attraverso l’utilizzo di micronutrienti quali il magnesio specificatamente sotto forma di complessi bisglicinati organici solubili ovvero la forma più facilmente assorbibile e tollerata a livello gastrointestinale[17].
In questi pazienti, il magnesio è efficace poiché penetra nelle cellule muscolari distendendole, agisce sulla muscolatura rilassandola e attenuando il dolore e contribuisce a produrre e sintetizzare Adenosina Trifosfato (ATP), l’energia necessaria alle cellule per svolgere qualsiasi tipo di lavoro[18-20].
I sintomi della fibromialgia includono anche stati di ansia, depressione e insonnia. Tutte condizioni che possono essere contrastate da una buona integrazione di L-Triptofano[21]. Quest’ultimo, infatti, è stato studiato in associazione ai disturbi sopraelencati per oltre 30 anni ed il principale meccanismo d’azione è legato al suo ruolo di precursore metabolico del neurotrasmettitore serotonina[22].
È stato dimostrato che anche altri neurotrasmettitori e sostanze chimiche del sistema nervoso centrale (SNC), come la melatonina, la dopamina, la norepinefrina e la beta-endorfina, aumentano in seguito alla somministrazione orale di L-Triptofano[23-26].
Ne consegue che in quanto tale, quest’ultimo possa rivelarsi un valido ausilio nel miglioramento del tono dell’umore e del ritmo veglia/sonno.
Infine, non è da sottovalutare in queste condizioni la supplementazione di vitamine del gruppo B (come Riboflavina e Niacina), in virtù degli effetti armonizzanti che questi nutrienti esercitano sulla sfera neurovegetativa e sulla dilatazione dei vasi sanguigni [27,28], e quella di Vitamina D3 che, fisiologicamente, determina un’azione anabolica sul muscolo, migliorando il trofismo e la performance dei fasci muscolari [29].
Concludendo, la gestione del paziente influisce fortemente sul decorso della patologia. Molti infatti, subiscono un impatto significativo sulla qualità della vita e sulla disabilità[30].
La consapevolezza riguardo la patologia è ormai consolidata e l’approccio basato sull’impiego di principi attivi naturali, sia in associazione che in alternativa al trattamento farmacologico standard, potrebbe rappresentare una strategia vincente per la gestione del paziente fibromialgico, soprattutto laddove la terapia sintomatica è di per sè priva di azione sui processi causali e spesso mal tollerata dal paziente.
Dott. Pasquale Cozzolino – Specialista in Neurologia
BIBLIOGRAFIA
- Clauw DJ. Fibromyalgia: a clinical review. JAMA. 2014;311:1547-55.
- Queiroz LP. “Worldwide Epidemiology of Fibromyalgia” Current Pain and Headache Reports 2013, 17:356.
- Miró E, Diener FN, Martínez MP, Sánchez AI, Valenza MC. La fibromialgia en hombres y mujeres: comparación de los principales síntomas clínicos [Fibromyalgia in men and women: comparison of the main clinical symptoms]. Psicothema. 2012 Feb;24(1):10-5. Spanish. PMID: 22269357.
- Wang SM, Han C, Lee SJ, Patkar AA, Masand PS, Pae CU. Fibromyalgia diagnosis: a review of the past, present and future. Expert Rev Neurother. 2015 Jun;15(6):667-79. doi: 10.1586/14737175.2015.1046841. PMID: 26035624.
- Bair MJ, Krebs EE. Fibromyalgia. Ann Intern Med. 2020 Mar 3;172(5):ITC33-ITC48. doi: 10.7326/AITC202003030. PMID: 32120395.
- O’Brien AT, Deitos A, Trin˜ anes Pego Y, et al. Defective endogenous pain modulation in fibromyalgia: a meta-analysis of temporal summation and conditioned pain modulation paradigms. J Pain. 2018;19:819-36.
- Maffei ME. Fibromyalgia: Recent Advances in Diagnosis, Classification, Pharmacotherapy and Alternative Remedies. Int J Mol Sci. 2020 Oct 23;21(21):7877. doi: 10.3390/ijms21217877. PMID: 33114203; PMCID: PMC7660651.
- Sarzi-Puttini P, Giorgi V, Marotto D, Atzeni F. Fibromyalgia: an update on clinical characteristics, aetiopathogenesis and treatment. Nat Rev Rheumatol. 2020 Nov;16(11):645-660. doi: 10.1038/s41584-020-00506-w. Epub 2020 Oct 6. PMID: 33024295.
- Wolfe, F., Clauw, D.J., Fitzcharles, M.-A., Goldenberg, D.L., Katz, R.S., Mease, P., Russell, A.S., Russell, I.J., Winfield, J.B. and Yunus, M.B. (2010), The American College of Rheumatology Preliminary Diagnostic Criteria for Fibromyalgia and Measurement of Symptom Severity. Arthritis Care Res, 62: 600-610.
- Wolfe F, Clauw DJ, Fitzcharles MA, Goldenberg DL, Häuser W, Katz RS, Mease P, Russell AS, Russell IJ, Winfield JB. Fibromyalgia criteria and severity scales for clinical and epidemiological studies: a modification of the ACR Preliminary Diagnostic Criteria for Fibromyalgia. J Rheumatol. 2011 Jun;38(6):1113-22. doi: 10.3899/jrheum.100594. Epub 2011 Feb 1. PMID: 21285161.
- Starz, T. W., and M. T. Bogt. “Fibromyalgia-its not all in my head.” Pain Practice 18.62-70 (2008).
- Sumpton JE, Moulin DE. Fibromyalgia. Handb Clin Neurol. 2014;119:513-27. doi: 10.1016/B978-0-7020-4086-3.00033-3. PMID: 24365316.
- Boomershine, C., Crofford, L. A symptom-based approach to pharmacologic management of fibromyalgia. Nat Rev Rheumatol 5, 191–199 (2009).
- Siddiqui MZ. Boswellia serrata, a potential antiinflammatory agent: an overview. Indian J Pharm Sci. 2011 May;73(3):255-61. doi: 10.4103/0250-474X.93507. PMID: 22457547; PMCID: PMC3309643.
- Safayhi H, Mack T, Sabieraj J, Anazodo MI, Subramanian LR, Ammon HPT. Boswellic acids: novel, specific, non-redox inhibitors of lipoxygenase. J. of Pharmacol. Exp. Ther. 1992; 261: 1143-1146.
- Chinn S, Caldwell W, Gritsenko K. Fibromyalgia Pathogenesis and Treatment Options Update. Curr Pain Headache Rep. 2016 Apr;20(4):25. doi: 10.1007/s11916-016-0556-x. PMID: 26922414.
- Siebrecht, Stefan. “Magnesium Bisglycinate as safe form for mineral supplementation in human nutrition.” (2013).
- Rude RK. Magnesium deficiency: a cause of heterogeneous disease in humans. J Bone Miner Res. 1998 Apr;13(4):749-58. doi: 10.1359/jbmr.1998.13.4.749. PMID: 9556074.
- Garrison SR, Allan GM, Sekhon RK, Musini VM, Khan KM. Magnesium for skeletal muscle cramps. Cochrane Database Syst Rev. 2012 Sep 12;2012(9):CD009402. doi: 10.1002/14651858.CD009402.pub2. Update in: Cochrane Database Syst Rev. 2020 Sep 21;9:CD009402. PMID: 22972143; PMCID: PMC7025716.
- Macian N, Dualé C, Voute M, Leray V, Courrent M, Bodé P, Giron F, Sonneville S, Bernard L, Joanny F, Menard K, Ducheix G, Pereira B, Pickering G. Short-Term Magnesium Therapy Alleviates Moderate Stress in Patients with Fibromyalgia: A Randomized Double-Blind Clinical Trial. Nutrients. 2022 May 17;14(10):2088. doi: 10.3390/nu14102088. PMID: 35631229; PMCID: PMC9145501.
- Richard DM, Dawes MA, Mathias CW, Acheson A, Hill-Kapturczak N, Dougherty DM. L-Tryptophan: Basic Metabolic Functions, Behavioral Research and Therapeutic Indications. Int J Tryptophan Res. 2009 Mar 23;2:45-60. doi: 10.4137/ijtr.s2129. PMID: 20651948; PMCID: PMC2908021.
- L-Tryptophan. Monograph. Altern Med Rev. 2006 Mar;11(1):52-6. PMID: 16597195.
- van Praag HM, Lemus C. Monoamine precursors in the treatment of psychiatric disorders. In: Wurtman RJ, Wurtman JJ, eds. Nutrition and the Brain. New York, NY: Raven Press; 1986:89-139.
- Den Boer JA, Westenberg HG. Behavioral, neuroendocrine, and biochemical effects of 5-hydroxytryptophan administration in panic disorder. Psychiatry Res 1990;31:267-278.
- Chadwick D, Jenner P, Harris R, et al. Manipulation of brain serotonin in the treatment of myoclonus. Lancet 1975;2:434-435.
- Guilleminault C, Tharp BR, Cousin D. HVA and 5HIAA CSF measurements and 5HTP trials in some patients with involuntary movements. J Neurol Sci 1973;18:435-441.
- Gasperi V, Sibilano M, Savini I, Catani MV. Niacin in the Central Nervous System: An Update of Biological Aspects and Clinical Applications. Int J Mol Sci. 2019 Feb 23;20(4):974. doi: 10.3390/ijms20040974. PMID: 30813414; PMCID: PMC6412771.
- Polegato BF, Pereira AG, Azevedo PS, Costa NA, Zornoff LAM, Paiva SAR, Minicucci MF. Role of Thiamin in Health and Disease. Nutr Clin Pract. 2019 Aug;34(4):558-564. doi: 10.1002/ncp.10234. Epub 2019 Jan 15. PMID: 30644592.
- Dawson-Hughes B. Vitamin D and muscle function. J Steroid Biochem Mol Biol. 2017 Oct;173:313-316. doi: 10.1016/j.jsbmb.2017.03.018. Epub 2017 Mar 22. PMID: 28341251.
- Mease P. Fibromyalgia syndrome: review of clinical presentation, pathogenesis, outcome measures, and treatment. J Rheumatol Suppl. 2005 Aug;75:6-21. Erratum in: J Rheumatol Suppl. 2005 Oct;32(10):2063. PMID: 16078356.

PHARMACEUTICAL CARE: LA NUOVA FRONTIERA DELLA SALUTE
by Medin Blog | 10 Dicembre 2020 | Video | 0 Comments
La Farmacia dei Servizi rappresenta il punto di arrivo dell’evoluzione di questa professione.
In un contesto sociale sempre più smart e in continuo cambiamento, gli attori principali di questo scenario sono Farmacisti, Medici e Pazienti, che oggi più che mai hanno bisogno di uno spazio comunicativo digitale, dinamico e interattivo.
Dall’analisi delle esigenze di queste categorie nasce il nostro progetto, Medin Service, che vuole dare risposte e supporto ai Professionisti della Salute per la cura dei Pazienti.
I BENEFICI DELLA MAGNETOTERAPIA
by Medin Blog | 10 Dicembre 2020 | Video | 0 Comments
La magnetoterapia è una tecnica che sfrutta i benefici dei campi magnetici a scopo curativo e riabilitativo. Per capire bene come funziona, è necessario illustrare innanzitutto il concetto di campo magnetico. Se applicata sul nostro corpo, l’azione dei campi magnetici è in grado di ristabilire l’equilibrio biochimico delle cellule qualora questo sia compromesso, ripristinando la corretta funzionalità della membrana cellulare. La magnetoterapia agisce soprattutto sul sistema osseo, articolare, muscolare e vascolare. Schematizzando, ecco quali sono i principali benefici per il nostro organismo:
- espleta un’azione antinfiammatoria
- ha un effetto antalgico/antidolorifico
- accelera la calcificazione delle fratture
- aumenta l’irrorazione vascolare e la velocità di scorrimento del sangue
- migliora la circolazione periferica
- accelera la cicatrizzazione di ferite, piaghe, e la guarigione dei tessuti molli
- migliora il metabolismo della cute
- svolge un’azione antinvecchiamento dei tessuti.
I contenuti di questo articolo sono pubblicati solo a scopo informativo, pertanto non sostituiscono il parere del medico.
FONTI
F. Ambrosi, “Magnetoterapia a campo stabile”.
W. Hulke. “Magnetoterapia. Principi fondamentali ed effetti terapeutici”.
I nostri Articoli
NUOVE SOLUZIONE CONSERVATIVE NEL TRATTAMENTO DELL’OSTEOARTROSI: CONDROPROTEZIONE E VISCOSUPPLEMENTAZIONE
by Dott. Alessandro Cerino | Apr 23, 2024
MIGLIORAMENTO DEGLI INDICI CLINIMETRICI IN PAZIENTI CON ARTROSI DOPO IL TRATTAMENTO CON UN PRODOTTO A BASE DI N-ACETIL-D-GLUCOSAMINA, CONDOITIN SOLFATO, METILSULFONILMETANO (MSM), BOSWELLIA SERRATA, SILICE E VITAMINA C
by dott. Marco Tasso | Mar 4, 2024
L’IMPIEGO DI ATTIVI NATURALI NELLA GESTIONE DEL PAZIENTE GONARTROSICO
by Dott. Raffaele Franzese | Feb 15, 2024
IMPIEGO DEI NUTRACEUTICI NEL TRATTAMENTO CRONICO DEI PAZIENTI FIBROMIALGICI
by Dott. Pasquale Cozzolino | Gen 2, 2024
L’IMPIEGO DI CONDROPROTTETTORI COME TERAPIA DI MANTENIMENTO DOPO CICLO INFILTRATIVO CON ACIDO IALURONICO NEL PAZIENTE CON ARTROSI AL GINOCCHIO
by Dott. Vincenzo Secondulfo | Set 19, 2023
STUDIO OSSERVAZIONALE: Impiego di una combinazione di L-Citrullina, Betaina e Fosfoserina nel miglioramento della qualità spermatica in maschi adulti affetti da oligospermia lieve
by Dott. Omero Simone | Ott 4, 2022
I nostri Video
PHARMACEUTICAL CARE: LA NUOVA FRONTIERA DELLA SALUTE
by Medin Blog | Dic 10, 2020
I BENEFICI DELLA MAGNETOTERAPIA
by Medin Blog | Dic 10, 2020