Medin Blog nasce con l’obiettivo di incoraggiare la divulgazione scientifica, all’interno di uno spazio digitale dinamico ed interattivo.
Una maggiore comprensione e consapevolezza può aiutare ad orientarsi nelle scelte di carattere sanitario, oltre ad essere un valido incentivo al sostegno dell’innovazione scientifica.
Contenuti in Evidenza
L’AZIONE MIORILASSANTE DEI NUTRACEUTICI NELLA GESTIONE DELLA CERVICALGIA: MECCANISMI FISIOLOGICI ED EVIDENZE CLINICHE
by Dott. Vincenzo Secondulfo | 2 Febbraio 2026 | Articoli | 0 Comments
La cervicalgia rappresenta una delle condizioni muscoloscheletriche più comuni nella popolazione adulta, con un’incidenza stimata tra il 30 e il 50% nel corso della vita [1]. È caratterizzata da dolore localizzato nella regione cervicale del rachide, tra C1 e C7, con durata variabile da poche settimane ad anni, e spesso presenta un andamento cronico-recidivante [2].
Le cause sono multifattoriali: alterazioni biomeccaniche, degenerative o infiammatorie delle strutture cervicali, ma anche disfunzioni muscolari secondarie a stress posturali, microtraumi ripetuti o tensioni di origine psicoemotiva.
L’aumento del tono muscolare e la contrattura cronica dei muscoli paravertebrali e del trapezio superiore giocano un ruolo cruciale nella genesi e nel mantenimento del dolore, generando rigidità e limitazione funzionale [2]. Oltre al dolore, la sintomatologia può includere vertigini, cefalea, irritabilità e insonnia, a conferma dell’interconnessione tra sistema muscolare, nervoso e neurovegetativo [3].
Negli ultimi anni, l’attenzione verso approcci terapeutici integrati ha promosso l’uso dei nutraceutici ad azione miorilassante come complemento o alternativa ai farmaci tradizionali, al fine di ridurre gli effetti collaterali e migliorare la qualità della vita.
La cervicalgia, infatti, è una condizione complessa nella quale la contrattura muscolare agisce sia come meccanismo difensivo sia come sorgente autonoma di dolore. Alterazioni del bilancio ionico intracellulare, accumulo di lattato e ridotta perfusione locale determinano ipossia tissutale e liberazione di mediatori algogeni che sensibilizzano i nocicettori [3]. La persistenza di questo stato conduce a ipereccitabilità neuromuscolare, rigidità e tensione cronica.
Il trattamento farmacologico tradizionale comprende FANS, corticosteroidi e miorilassanti di sintesi [2], ma questi ultimi (come tiocolchicoside e ciclobenzaprina) sono spesso associati ad effetti collaterali come: sonnolenza, ipotonia e disturbi gastrointestinali, con limitazioni d’uso nei pazienti anziani o polimedicati [4-6]. Da qui l’interesse crescente per i composti di origine naturale con attività miorilassante e antinfiammatoria, capaci di agire su più fronti fisiopatologici con un profilo di tollerabilità migliore.
Tra i principali nutraceutici di interesse clinico figurano il Magnesio, la Boswellia serrata, il L-Triptofano ed alcune vitamine, in particolare quelle del gruppo B e la vitamina D.
Il Magnesio, secondo catione intracellulare per abbondanza, partecipa a oltre 300 reazioni enzimatiche legate alla sintesi di ATP, al trasporto di ioni calcio e sodio e alla trasmissione neuromuscolare [7]. La sua carenza induce ipereccitabilità dei motoneuroni, favorendo crampi e contratture.
Studi su modelli animali hanno dimostrato che la deplezione di magnesio aumenta l’attività delle cellule muscolari e il rilascio di acetilcolina [8], mentre la supplementazione normalizza il flusso di calcio e riduce la liberazione di neurotrasmettitori eccitatori.
A livello clinico, gli studi hanno fornito risultati variabili: Garrison et al. (2020) [9] riportano un effetto modesto nei crampi idiopatici, ma significativo nei soggetti con deficit o in gravidanza. Altri lavori confermano che l’integrazione di magnesio migliora la tolleranza all’esercizio e riduce la rigidità muscolare grazie a un miglior metabolismo mitocondriale e minore stress ossidativo [10].
La Boswellia serrata, pianta indiana la cui resina contiene acidi boswellici, in particolare l’acido 3-O-acetil-11-cheto-β-boswellico (AKBA), agisce come potente inibitore della 5-lipossigenasi, riducendo la produzione di leucotrieni infiammatori [11]. A differenza dei FANS, non altera la via delle ciclossigenasi e non provoca gastrolesività, risultando adatta all’uso prolungato. Inoltre, la Boswellia mostra effetti miorilassanti diretti tramite la riduzione dello stress ossidativo e la modulazione dei recettori GABAergici, con miglioramento della mobilità cervicale [12,13].
Il L-Triptofano, amminoacido essenziale precursore della serotonina e della melatonina, contribuisce alla modulazione del tono muscolare e della percezione del dolore. A livello sperimentale, la somministrazione di triptofano riduce l’iperalgesia e aumenta la soglia nocicettiva [14]. L’aumento della serotonina centrale esercita un effetto inibitorio sui motoneuroni spinali, mentre la melatonina migliora la qualità del sonno, fattore strettamente correlato alla riduzione della tensione muscolare [15].
Una meta-analisi di Sutanto et al. (2021) [16] conferma che l’assunzione di triptofano può migliorare la latenza e l’efficienza del sonno, con effetti positivi anche sul dolore e sul rilassamento. Altri studi hanno evidenziato una riduzione dei livelli di ansia e una maggiore tolleranza al dolore nei pazienti con dolore cronico trattati con questo aminoacido [17].
In ambito clinico, la supplementazione di triptofano, soprattutto se assunta alla sera per 4-8 settimane, si è dimostrata utile nel supportare pazienti con dolore muscolare cronico, fibromialgia o disturbi del sonno [18].
L’associazione dei principi attivi discussi con le vitamine del gruppo B può potenziare l’effetto neuromodulatore e rilassante, grazie al loro ruolo neuroprotettivo, al supporto dei processi di mielinizzazione e al miglioramento della trasmissione nervosa. La vitamina D, invece, contribuisce al mantenimento dell’efficienza muscolare attraverso la regolazione della sintesi proteica e della contrattilità, prevenendo condizioni di debolezza e rigidità [22-25]. La sua carenza è stata inoltre associata a una maggiore incidenza di dolore muscolotensivo e cefalea cervicogenica [26].
In conclusione, le evidenze scientifiche più recenti confermano il ruolo dei nutraceutici come valido supporto nella gestione della cervicalgia. Diversi studi controllati hanno dimostrato che il magnesio contribuisce a ridurre dolore e rigidità muscolare, la Boswellia serrata migliora la mobilità e la sensibilità muscolare, mentre l’associazione tra L-triptofano e vitamine del gruppo B favorisce il rilassamento e il benessere neuropsichico. Nei soggetti con deficit, la vitamina D3 si è rivelata utile nel ridurre dolore e debolezza muscolare, evidenziando il legame tra metabolismo calcico e funzione neuromuscolare.
Una meta-analisi del 2023 ha inoltre mostrato che gli approcci multimodali basati su nutraceutici ad azione miorilassante offrono risultati superiori rispetto alla sola terapia farmacologica, soprattutto nei casi di dolore cronico.
Nel complesso, la cervicalgia rappresenta una condizione multifattoriale in cui la componente muscolare e neurovegetativa gioca un ruolo determinante. L’impiego mirato di nutraceutici consente di intervenire sui principali meccanismi fisiopatologici, favorendo il rilassamento muscolare, la modulazione dell’infiammazione e il riequilibrio della trasmissione neuromuscolare.
Grazie al loro profilo di sicurezza e alla buona tollerabilità nel lungo periodo, essi costituiscono un complemento efficace e sostenibile ai trattamenti farmacologici e fisioterapici convenzionali.
Dott. Vincenzo Secondulfo – Specialista in Ortopedia e Traumatologia
BIBLIOGRAFIA
- Kazeminasab S, Nejadghaderi SA, Amiri P, Pourfathi H, Araj-Khodaei M, Sullman MJM, Kolahi AA, Safiri S. Neck pain: global epidemiology, trends and risk factors. BMC Musculoskelet Disord. 2022 Jan 3;23(1):26. doi: 10.1186/s12891-021-04957-4. PMID: 34980079; PMCID: PMC8725362.
- Cohen SP. Epidemiology, diagnosis, and treatment of neck pain. Mayo Clin Proc. 2015 Feb;90(2):284-99. doi: 10.1016/j.mayocp.2014.09.008. PMID: 25659245.
- Misailidou V, Malliou P, Beneka A, Karagiannidis A, Godoliasf G. Assessment of patients with neck pain: a review of definitions, selection criteria, and measurement tools. J Chiropr Med. 2010 Jun; 9(2): 49–59.
- SWARTZ CH. Introduction to muscle relaxants. Calif Med. 1955 Sep;83(3):222-4. PMID: 13250425; PMCID: PMC1532716.
- Oldfield BJ, Gleeson B, Morford KL, Adams Z, Funaro MC, Becker WC, Merlin JS. Long-Term Use of Muscle Relaxant Medications for Chronic Pain: A Systematic Review. JAMA Netw Open. 2024 Sep 3;7(9):e2434835. doi: 10.1001/jamanetworkopen.2024.34835. PMID: 39298168; PMCID: PMC11413720.
- Kurotschka, Peter & Slawson, David & Serafini, Alice. (2025). Muscle relaxants: uncertain risk-benefit balance in chronic pain syndromes. Recenti Progressi in Medicina. 116. 55-56. 10.1701/4416.44121.
- Rude RK. Magnesium deficiency: a cause of heterogeneous disease in humans. J Bone Miner Res. 1998 Apr;13(4):749-58. doi: 10.1359/jbmr.1998.13.4.749. PMID: 9556074.
- Weglicki WB, Phillips TM. Pathobiology of magnesium deficiency: a cytokine/neurogenic inflammation hypothesis. Am J Physiol. 1992 Sep;263(3 Pt 2):R734-7. doi: 10.1152/ajpregu.1992.263.3.R734. PMID: 1384353.
- Garrison SR et al. Magnesium for skeletal muscle cramps. Cochrane Database Syst Rev. 2020;9:CD009402.
- Liguori S et al. Role of Magnesium in Skeletal Muscle Health. Nutrients. 2022;14(4):909.
- Ammon HP. Boswellic acids in chronic inflammatory diseases. Planta Med. 2006;72(12):1100–16.
- Rueda DC, Raith M, De Mieri M, Schöffmann A, Hering S, Hamburger M. Identification of dehydroabietc acid from Boswellia thurifera resin as a positive GABAA receptor modulator. Fitoterapia. 2014 Dec;99:28-34. doi: 10.1016/j.fitote.2014.09.002. Epub 2014 Sep 6. PMID: 25200370.
- Rueda DC, Raith M, De Mieri M, Schöffmann A, Hering S, Hamburger M. Identification of dehydroabietc acid from Boswellia thurifera resin as a positive GABAA receptor modulator. Fitoterapia. 2014 Dec;99:28-34. doi: 10.1016/j.fitote.2014.09.002. Epub 2014 Sep 6. PMID: 25200370
- Nakagawa Y et al. Tryptophan and serotonin in pain modulation: experimental evidence. Neurosci Lett. 2018;682:1–7.
- Srinivasan V et al. Melatonin, sleep, and pain: therapeutic potential. J Pain Res. 2012;5:427–37.
- Sutanto CN et al. Tryptophan supplementation and sleep quality: meta-analysis. Nutr Rev. 2021;79(6):693–707.
- Richard DM et al. L-Tryptophan: Basic metabolic functions and therapeutic indications. Int J Tryptophan Res. 2009;2:45–60.
- Young SN. Tryptophan, serotonin and human mood. J Psychiatry Neurosci. 2013;38(2):75–7.
- Gaul C, Diener HC, Danesch U; Migravent® Study Group. Improvement of migraine symptoms with a proprietary supplement containing riboflavin, magnesium and Q10: a randomized, placebo-controlled, double-blind, multicenter trial. J Headache Pain. 2015;16:516. doi: 10.1186/s10194-015-0516-6. Epub 2015 Apr 3. PMID: 25916335; PMCID: PMC4393401.
- Prousky J, Seely D. The treatment of migraines and tension-type headaches with intravenous and oral niacin (nicotinic acid): systematic review of the literature. Nutr J. 2005 Jan 26;4:3. doi: 10.1186/1475-2891-4-3. PMID: 15673472; PMCID: PMC548511.
- Shaik MM, Gan SH. Vitamin supplementation as possible prophylactic treatment against migraine with aura and menstrual migraine. Biomed Res Int. 2015;2015:469529. doi: 10.1155/2015/469529. Epub 2015 Feb 28. PMID: 25815319; PMCID: PMC4359851.
- Stockton KA, Mengersen K, Paratz JD, Kandiah D, Bennell KL. Effect of vitamin D supplementation on muscle strength: a systematic review and meta-analysis. Osteoporos Int. 2011 Mar;22(3):859-71. doi: 10.1007/s00198-010-1407-y. Epub 2010 Oct 6. PMID: 20924748.
- Schreuder F, Bernsen RM, van der Wouden JC. Vitamin D supplementation for nonspecific musculoskeletal pain in non-Western immigrants: a randomized controlled trial. Ann Fam Med. 2012 Nov-Dec;10(6):547-55. doi: 10.1370/afm.1402. PMID: 23149532; PMCID: PMC3495929.
- Prakash S, Rathore C, Makwana P, Dave A, Joshi H, Parekh H. Vitamin D Deficiency in Patients With Chronic Tension-Type Headache: A Case-Control Study. Headache. 2017 Jul;57(7):1096-1108. doi: 10.1111/head.13096. Epub 2017 May 3. PMID: 28470754.
- Bislev LS, Grove-Laugesen D, Rejnmark L. Vitamin D and Muscle Health: A Systematic Review and Meta-analysis of Randomized Placebo-Controlled Trials. J Bone Miner Res. 2021 Sep;36(9):1651-1660. doi: 10.1002/jbmr.4412. Epub 2021 Aug 17. PMID: 34405916.
- Channarong P, Phongamwong C. Prevalence and risk factors of vitamin D deficiency among patients with chronic myofascial pain syndrome: a cross-sectional study. BMC Nutr. 2023 Nov 14;9(1):129. doi: 10.1186/s40795-023-00792-z. PMID: 37964354; PMCID: PMC10647172.
L’UTILLIZZO DEL SELENIO NEL TRATTAMENTO DELLE TIROIDITI CRONICHE IN PAZIENTI IN EUTIREOSI
by Dott.ssa Luciana Vergnani | 29 Gennaio 2026 | Articoli | 0 Comments
La tiroidite cronica autoimmune, comunemente conosciuta come tiroidite di Hashimoto, rappresenta una delle più frequenti cause di disfunzione tiroidea nelle popolazioni con adeguato apporto iodico [1].
È caratterizzata da un processo infiammatorio cronico, mediato da meccanismi autoimmuni, che porta nel tempo alla progressiva distruzione del tessuto tiroideo e, in molti casi, allo sviluppo di ipotiroidismo conclamato [2,3]. Tuttavia, esiste una quota non trascurabile di pazienti che rimane in condizione di eutireosi, pur presentando la positività per gli anticorpi anti-tiroide (anti-TPO e/o anti-Tg) e segni ecografici di tiroidite cronica [4].
In questi casi, il ruolo di un intervento terapeutico mirato a modulare la risposta autoimmune, senza necessariamente ricorrere alla terapia sostitutiva con L-tiroxina, è stato oggetto di crescente interesse clinico. Tra le varie sostanze indagate, il selenio (Se) si è imposto come uno degli oligoelementi più promettenti nel modulare la risposta immunitaria tiroidei [5].
Il selenio è un elemento essenziale per la fisiologia umana e parte integrante di diverse selenoproteine coinvolte nella difesa antiossidante e nella regolazione della funzione tiroidei [6].
La tiroide, in particolare, presenta la più alta concentrazione di selenio per grammo di tessuto rispetto a qualsiasi altro organo del corpo umano [7,8]. Questa peculiarità riflette il ruolo cruciale che le selenoproteine svolgono nel mantenimento dell’integrità strutturale e funzionale della ghiandola.
Il metabolismo ormonale tiroideo è strettamente dipendente da enzimi selenio-dipendenti. Le iodotironina deiodinasi (D1, D2 e D3), responsabili della conversione della tiroxina (T4) nella forma metabolicamente attiva triiodotironina (T3), sono selenoproteine. Allo stesso modo, la glutatione perossidasi (GPx) e la tioredossina reduttasi (TrxR) proteggono la tiroide dal danno ossidativo, neutralizzando il perossido di idrogeno (H2O2) prodotto durante la sintesi ormonale [6,9].
Una carenza di selenio comporta quindi una riduzione dell’attività antiossidante locale, con conseguente aumento dello stress ossidativo e maggiore suscettibilità del tessuto tiroideo a processi infiammatori autoimmune [10].
Diversi studi hanno dimostrato che il selenio esercita anche un effetto immunomodulatore, influenzando l’attività dei linfociti T e B e la produzione di citochine proinfiammatorie. Questi effetti possono ridurre la risposta autoimmune contro la tiroide, spiegando la riduzione dei titoli anticorpali anti-TPO osservata in molte sperimentazioni cliniche [11].
Il primo studio randomizzato controllato di rilievo è stato condotto da Gärtner et al. nel 2002, che dimostrò come la supplementazione di selenito di sodio per tre mesi determinasse una riduzione significativa dei livelli di anticorpi anti-TPO nei pazienti con tiroidite autoimmune [12]. Successivamente, diversi studi hanno confermato risultati simili, anche se con una certa eterogeneità dovuta a differenze nella popolazione studiata, nella forma chimica di selenio utilizzata (selenito vs selenometionina) e nella durata della supplementazione.
Meta-analisi più recenti hanno evidenziato che la supplementazione con selenio, in particolare con selenometionina, può ridurre i livelli di autoanticorpi e migliorare alcuni parametri ecografici della tiroide [13,14]. Tuttavia, i benefici clinici in termini di sintomi o prevenzione dell’ipotiroidismo rimangono meno chiari. Nonostante ciò, la riduzione del carico autoimmune rappresenta un obiettivo potenzialmente utile nei pazienti eutiroidei, poiché potrebbe rallentare la progressione verso l’ipotiroidismo conclamato [15-23].
Nel contesto della tiroidite cronica in eutireosi, l’obiettivo principale dell’integrazione con selenio non è tanto la normalizzazione della funzione ormonale, quanto la modulazione dell’infiammazione e della risposta autoimmune. Diversi studi prospettici hanno dimostrato che l’assunzione di selenio può contribuire a mantenere la stabilità funzionale tiroidea nel tempo [21]. Questo effetto sembrerebbe più marcato nei soggetti con bassi livelli sierici di selenio o in aree geografiche a basso contenuto di selenio nel suolo.
Inoltre, il selenio può esercitare un’azione positiva sulla qualità di vita dei pazienti, riducendo sintomi aspecifici come affaticamento, irritabilità o senso di gonfiore cervicale, spesso riferiti anche in presenza di funzione tiroidea normale [19]. Tali benefici soggettivi, seppur difficili da quantificare, rappresentano un aspetto clinicamente rilevante nella gestione del paziente eutiroideo con tiroidite autoimmune.
Nei principali studi clinici, le forme di selenio più utilizzate sono il selenito di sodio (inorganico) e la selenometionina (organica), quest’ultima caratterizzata da una maggiore biodisponibilità e da un profilo di sicurezza ottimale.
Nella pratica clinica, l’integrazione di selenio può essere considerata nei seguenti casi:
- Pazienti con tiroidite cronica autoimmune in eutireosi, con elevati titoli di anti-TPO o anti-Tg;
- Pazienti che presentano sintomi aspecifici nonostante la normale funzione tiroidea;
- Soggetti residenti in aree geografiche a basso contenuto di selenio;
- Donne con tiroidite autoimmune che pianificano una gravidanza o sono nel periodo post-partum, in cui la fluttuazione della risposta immune può peggiorare la funzione tiroidea [24].
Il monitoraggio durante la supplementazione dovrebbe includere la valutazione periodica dei livelli sierici di TSH, FT4, FT3 e anticorpi anti-TPO, oltre all’osservazione clinica dei sintomi.
Le principali società scientifiche, tra cui l’European Thyroid Association (ETA), riconoscono il potenziale beneficio del selenio nel favorire la riduzione del titolo anticorpale nei pazienti con tiroidite autoimmune [25], e indicano come ottimale un apporto giornaliero compreso tra 55 e 75 microgrammi per garantire la massima attività degli enzimi antiossidanti tiroidei [26, 27].
In conclusione, il selenio si configura come un elemento di rilievo nella gestione delle tiroiditi croniche autoimmuni, in particolare nei pazienti eutiroidei per i quali non sussiste ancora indicazione alla terapia sostitutiva. Le sue proprietà antiossidanti e immunomodulanti possono contribuire alla modulazione dell’attività autoimmune e al mantenimento della funzione tiroidea nel tempo.
Ulteriori studi prospettici e di lunga durata risultano tuttavia necessari per definire con maggiore precisione l’impatto del selenio sugli esiti clinici della tiroidite autoimmune e per individuare le categorie di pazienti che possono trarre il massimo beneficio da un’integrazione mirata.
Dott.ssa Luciana Vergnani – Specialista in Endocrinologia
BIBLIOGRAFIA
- Hashimoto’s Disease”. NIDDK. May 2014. Archived from the original on 22 August 2016. Retrieved 9 August 2016.
- Hiromatsu Y, Satoh H, Amino N. Hashimoto’s thyroiditis: history and future outlook. Hormones (Athens). 2013 Jan-Mar;12(1):12-8.
- Fröhlich E, Wahl R. Thyroid Autoimmunity: Role of Anti-thyroid Antibodies in Thyroid and Extra-Thyroidal Diseases. Front Immunol. 2017 May 9;8:521.
- Patti M, Christian R, Palokas M. Association between anti-thyroid antibodies and quality of life in patients with Hashimoto thyroiditis: a systematic review and meta-analysis. JBI Evid Synth. 2021 Sep;19(9):2307-2338. doi: 10.11124/JBIES-20-00043. PMID: 33741837.
- Caturegli P, De Remigis A, Rose NR. Hashimoto thyroiditis: clinical and diagnostic criteria. Autoimmun Rev. 2014 Apr-May;13(4-5):391-7.
- Ragozzino G, Tanzilli V, Cristiano NMV, Guarino G, Mattera E. Selenium: Properties and Clinical Applications. A Systematic Review. Int J Clin Endocrinol. 2017;1(1): 008-017.
- Beckett GJ, Arthur JR. Selenium and endocrine systems. J Endocrinol. 2005;184:455–465.
- Ventura M, Melo M, Carrilho F. Selenium and Thyroid Disease: From Pathophysiology to Treatment. Int J Endocrinol. 2017;2017:1297658.
- Duntas LH. The role of selenium in thyroid autoimmunity and cancer. Thyroid. 2006;16:455–460.
- Duntas LH. Environmental factors and autoimmune thyroiditis. Nat Clin Pract Endocrinol Metab. 2008 Aug;4(8):454-60.
- Ventura M, Melo M, Carrilho F. Selenium and Thyroid Disease: From Pathophysiology to Treatment. Int J Endocrinol. 2017;2017:1297658.
- Gärtner R, Gasnier BC, Dietrich JW, et al. Selenium supplementation in patients with autoimmune thyroiditis decreases thyroid peroxidase antibodies concentrations. J Clin Endocrinol Metab. 2002;87(4):1687–1691.
- Wichman J, Winther KH, Bonnema SJ, Hegedüs L. Selenium Supplementation Significantly Reduces Thyroid Autoantibody Levels in Patients with Chronic Autoimmune Thyroiditis: A Systematic Review and Meta-Analysis. Thyroid. 2016;26(12):1681–1692.
- Toulis KA et al. Selenium supplementation in the treatment of Hashimoto’s thyroiditis: a systematic review and a meta-analysis. Thyroid. 2010;20(10):1163–1173.
- Gartner R, Gasnier BC, Dietrich JW, et al. Selenium supplementation in patients with autoimmune thyroiditis decreases thyroid peroxidase antibodies concentrations. J Clin Endocrinol Metab 2002; 87: 1687-1691.
- Duntas LH, Mantzou E, Koutras DA. Effects of a six month treatment with selenomethionine in patients with autoimmune thyroiditis. Eur J Endocrinol 2003; 148: 389-393.
- Turker O, Kumanlioglu K, Karapolat I, Dogan I. Selenium treatment in autoimmune thyroiditis: 9-month follow-up with variable doses. J Endocrinol 2006; 190: 151-156.
- Mazokopakis EE, Papadakis JA, Papadomanolaki MG, et al. Effects of 12 months treatment with L-selenomethionine on serum anti-TPO levels in patients with Hashimoto’s thyroiditis. Thyroid (in press).
- Krysiak R, Okopien B. The effect of levothyroxine and selenomethionine on lymphocyte and monocyte cytokine release in women with Hashimoto’s thyroiditis. J Clin Endocrinol Metab. 2011 Jul;96(7):2206-15.
- Esposito D, Rotondi M, Accardo G, Vallone G, Conzo G, Docimo G, Selvaggi F, Cappelli C, Chiovato L, Giugliano D, Pasquali D. Influence of short-term selenium supplementation on the natural course of Hashimoto’s thyroiditis: clinical results of a blinded placebo-controlled randomized prospective trial. J Endocrinol Invest. 2017 Jan;40(1):83-89.
- Pirola I, Gandossi E, Agosti B, Delbarba A, Cappelli C. Selenium supplementation could restore euthyroidism in subclinical hypothyroid patients with autoimmune thyroiditis. Endokrynol Pol. 2016;67(6):567-571.
- Toulis KA, Anastasilakis AD, Tzellos TG, Goulis DG, Kouvelas D. Selenium supplementation in the treatment of Hashimoto’s thyroiditis: a systematic review and a meta-analysis. Thyroid. 2010 Oct;20(10):1163-73.
- Wichman J, Winther KH, Bonnema SJ, Hegedüs L. Selenium Supplementation Significantly Reduces Thyroid Autoantibody Levels in Patients with Chronic Autoimmune Thyroiditis: A Systematic Review and Meta-Analysis. Thyroid. 2016 Dec;26(12):1681-1692.
- Negro R, et al. Selenium supplementation in pregnant women with thyroid autoimmunity: effects on postpartum thyroiditis and permanent hypothyroidism. J Clin Endocrinol Metab. 2007;92:1263–1268.
- Winther KH, et al. European Thyroid Association Survey on the Use of Selenium in Autoimmune Thyroid Disease. Eur Thyroid J. 2020;9(2):99–106.
- Rayman MP. The importance of selenium to human health. Lancet 2000; 356: 233-241.
- Dietary Reference Intakes (DRI). National Research Council. Washington: National Academy Press; 2000; 284-319.

NUOVE SOLUZIONE CONSERVATIVE NEL TRATTAMENTO DELL’OSTEOARTROSI: CONDROPROTEZIONE E VISCOSUPPLEMENTAZIONE
by Dott. Alessandro Cerino | 23 Aprile 2024 | Articoli | 0 Comments
In Italia le malattie reumatiche colpiscono circa 5 milioni e mezzo di abitanti, un decimo della popolazione totale. Tra queste, l’Osteoartrosi (OA) è di gran lunga l’affezione più frequente, rappresentando da sola circa il 72% dei casi con un’incidenza che aumenta con l’aumentare dell’età [1].
L’OA è un processo patologico di natura degenerativa che trae origine dalla perdita del fisiologico equilibrio tra fenomeni catabolici e fenomeni riparativi a livello della cartilagine articolare. Il processo coinvolge anche l’osso subcondrale, la membrana sinoviale e determina uno scompenso globale a carico dell’articolazione.
La patogenesi dell’artrosi non è stata ancora completamente chiarita [2]. L’ipotesi più accreditata evidenzia come sollecitazioni meccaniche eccessive che agiscono su una cartilagine normale o alterazioni cartilaginee intrinseche determinino una aumentata produzione da parte dei condrociti di Metalloproteasi di matrice (MMPs), una famiglia di endopeptidasi zinco-dipendenti in grado di degradare la matrice extracellulare, con conseguente degradazione della matrice cartilaginea e liberazione di detriti nel liquido sinoviale. Questi detriti fagocitati dalla membrana sinoviale stimolano i sinoviociti a produrre citochine pro-infiammatorie (principalmente IL-1 e TNF-a) che, a loro volta, inducono i condrociti a produrre NO e PGE2, amplificando così il processo flogistico-degenerativo [3].
L’OA è, per diversi fattori, una patologia particolarmente difficile da trattare: innanzitutto è una patologia che tende a cronicizzare e, in quanto tale necessita di terapie di lungo periodo. La cronicizzazione della patologia si accompagna inoltre allo sviluppo di un’invalidità che, a seconda del decorso della patologia, può essere più o meno grave e comportare costi sociali e personali più o meno elevati [4].
Le linee guida ACR (American College of Rheumatology) 2019 [5] per la gestione del paziente artrosico includono una combinazione di interventi farmacologici (Terapia sintomatica, Terapia intrarticolare e Terapia di fondo) e non farmacologici (perdita di peso, programmi di istruzione del paziente, esercizio fisico e così via), mentre la chirurgia viene di solito riservata solo alle forme più gravi nelle quali il dolore e la difficoltà di movimento impediscono al paziente di condurre una vita normale.
Ad ogni modo, ad oggi, non esistono terapie farmacologiche specifiche in grado di prevenire la progressione del danno articolare causato da OA, ma la terapia standard prevede l’adozione di un regime terapeutico basato su una combinazione di Farmaci sintomatici ad azione rapida (Fast-Acting Drug for OsteoArthritis) e
Farmaci sintomatici ad azione lenta (SYmptomatic Slow-Acting Drugs for OsteoArthritis) [6]. Appartengono alla prima categoria i FANS, gli Analgesici e i Corticosteroidi classici; questi farmaci hanno il vantaggio di esercitare un effetto immediato sugli stati infiammatori responsabili del dolore (quindi sul sintomo), ma non esercitano alcun’azione sulle cause della patologia osteoartrosica e spesso producono effetti collaterali non trascurabili (gestrointestinali, renali e cardiovascolari) che non ne rendono consigliabile l’impiego sul lungo periodo [7,8]. Congiuntamente ai farmaci sintomatici classici è oramai di uso comune nella gestione del paziente con OA il ricorso ai cosiddetti SYSADOA [9-11]. Si tratta di principi attivi in grado di stimolare la sintesi dei principali costituenti della cartilagine articolare (Glicosaminoglicani, Proteoglicani e Collagene), fornendo così nutrimento e sostegno all’articolazione artrosica, conservare le condizioni di vitalità dei ondrociti e mantenere inalterate le caratteristiche del liquido sinoviale [12].
Appartiene a questa categoria tra le altre, l’acido ialuronico (HA) somministrato principalmente per via intrarticolare (viscosupplementazione) [13].
Il concetto di viscosupplementazione (VS) venne introdotto nel 1993 da Balazs [13] come nuova strategia terapeutica per il trattamento di patologie, come l’osteoartrosi, responsabili di un’alterazione qualitativa e quantitativa del liquido sinoviale delle articolazioni.
Balazs per primo ipotizzò che l’iniezione intra-articolare di HA nelle articolazioni osteoartrosiche avrebbe avuto la capacità di ripristinare la viscoelasticità del liquido sinoviale, di aumentare il flusso di liquido articolare, di normalizzare la sintesi endogena di ialuronato, di inibire la degradazione di ialuronato, di ridurre il dolore articolare e di migliorare la funzionalità dell’articolazione [13].
Attualmente, numerosi studi dimostrano con sempre maggior evidenza, come cicli ripetuti di iniezioni ecoguidate intra-articolari di HA, comportino un notevole miglioramento della sintomatologia dolorosa nonché della funzionalità articolare e del consumo di analgesici evidenziando inoltre, un netto ritardo per gli interventi di protesizzazione delle articolazioni interessate dal processo patologico [14,15].
Nonostante ciò, le linee guida e le raccomandazioni delle diverse Società sono spesso in contraddizione tra loro questo perché il principale svantaggio offerto da suddetta terapia è che il processo infiammatorio in corso riduce notevolmente il suo effetto, dal momento che la produzione di enzimi litici, degrada ulteriormente l’articolazione [16].
Ne consegue che molte evidenze hanno cominciato a porre l’accento sull’associazione di VS e condroprotezione orale.
In uno studio randomizzato open label, 40 pazienti con OA del ginocchio di grado lieve-moderato sono stati assegnati a ricevere VS intrarticolare con HA per 5 settimane, seguita o meno da condroprotezione orale per 6 mesi. Entrambi i gruppi hanno riportato significativi benefici alla conclusione della terapia infiltrativa rispetto alla situazione basale, ma solo i pazienti che assumevano condroprotezione orale, hanno mantenuto i punteggi di VAS e Lequesne a 6 mesi significativamente ridotti da quelli basali [17].
La condroprotezione orale, nello specifico prevede l’utilizzo di un gruppo di principi attivi che prendono il nome di Inibitori delle Metalloproteasi di matrice (MMPs). Come visto in precedenza l’attivazione delle MMPs rappresenta il trigger patologico in grado di innescare il processo infiammatorio a livello articolare [18-21].
Bloccare questi enzimi, significa pertanto ritardare la degenerazione cartilaginea, arrestando al contempo il processo flogistico a valle [22,23].
Appartengono a questa categoria: N-Acetil-D-glucosammina, Condroitin solfato, Metilsulfonilmetano e Boswellia serrata.
La N-Acetil-D-Glucosamina (NAG) è un aminozucchero precursore della sintesi dei Glicosaminoglicani (GAGs), i principali costituenti della cartilagine articolare. Così come le altre forme di Glucosammina presenti sul mercato (Glucosammina solfato e Glucosammina cloridrato), la NAG è in grado di stimolare la sintesi dei principali costituenti della matrice cartilaginea (GAGs, PGs e Acido ialuronico), fornendo nutrimento e sostegno trofico all’articolazione. La NAG presenta inoltre dei vantaggi sostanziali che ne incoraggiano l’uso rispetto alle altre forme di Glucosammina [24]. In particolare, a differenza della Glucosammina solfato e cloridrato, la NAG è in grado di operare l’inibizione delle MMPs, rallentando l’erosione della matrice cartilazionea e il conseguente processo di flogosi, stimolare la sintesi di HA, esplicare un’interessante azione antinfiammatoria, non inibire la sintesi di Glucosammina endogena e non indurre insulino-resistenza.
Tant’è vero che, ad oggi, la NAG, rappresenta l’unica forma di Glucosamina ad aver ottenuto una specifica indicazione terapeutica da parte del Ministero della Salute italiano.
Un altro principio attivo in grado di provocare l’inibizione delle MMPs e da tempo utilizzato nella gestione del paziente artrosico è la Condroitin solfato. Quest’ultima, rappresenta il GAG più abbondante a livello della cartilagine articolare, dove ne rappresenta il maggiore responsabile della resistenza alla compressione, tant’è vero che l’impoverimento in Condroitin solfato della cartilagine articolare rappresenta una tra le principali cause di OA [25-29].
Il beneficio apportato dalla Condroitin solfato nei pazienti affetti da OA è presumibilmente il risultato di varie azioni: stimolazione della sintesi di Proteoglicani e Acido ialuronico, inibizione dell’attività erosiva delle MMPs, azione antinfiammatoria e inibizione dell’apoptosi dei condrociti articolari [25-29].
In diversi studi clinici, la Glucosamina e la Condroitina sono state associate ad altri principi attivi naturali che hanno prodotto risultati promettenti nel trattamento delle patologie su base infiammatoria: Si tratta del Metilsulfonilmetano (MSM) e della Boswellia serrata (BS) [30-32].
Il Metilsulfonilmetano (MSM) rappresenta la forma naturale dello zolfo organico [33]. L’azione protettiva
dell’MSM sulla cartilagine articolare, si deve al ruolo svolto dallo zolfo nella sintesi del Collagene; la presenza dello zolfo serve infatti a garantire la formazione dei legami disolfuro tra le triple eliche del Procollagene, promuovendo la formazione dei tessuti elastici quali appunto la cartilagine articolare. Il Metilsulfonilmetano inibisce inoltre l’attivazione delle MMPs ed è in grado di migliorare la permeabilità cellulare, permettendo alle sostanze dannose di essere eliminate più facilmente e prevenendo così un possibile aumento della pressione intracellulare che è causa di dolore e infiammazione. Il MSM inibisce infine la trasmissione dell’impulso doloroso attraverso le fibre nervose di tipo C e svolge una discreta azione antispasmodica, riducendo l’incidenza di dolore e crampi muscolari [34,35].
La Boswellia serrata, è un albero di grandi dimensioni che cresce nelle regioni montuose di India, Nord Africa e Medio Oriente. La gommoresina di questa pianta è ricca di numerosi principi attivi, tra cui spiccano per importanza gli Acidi cheto-boswellici (AKBA) [36]. Quest’ultimi sono in grado di inibire selettivamente l’enzima 5-Lipossigenasi, coinvolto nella biosintesi di importanti mediatori del processo infiammatorio: i
Leucotrieni. La selettività di inibizione relativa alla sola Lipossigenasi e non della Ciclossigenasi, rende l’azione antinfiammatoria degli Acidi Boswellici particolarmente interessante ed utile ai fini terapeutici, in quanto non determina in nessun caso gastrolesività (al contrario dei FANS). Gli Acidi boswellici si sono inoltre dimostrati in grado di bloccare la migrazione dei leucociti polimorfonucleati verso i siti di flogosi. Ciò fornisce un notevole vantaggio terapeutico, dal momento che, se non bloccate, queste cellule, una volta giunte sul sito dell’infiammazione, rilasciano una serie di enzimi ad azione proteolitica (Elastasi, Glucuronidasi, N- Acetilglucosaminidasi, ec..), responsabili della distruzione del collagene e dei tessuti elastici (Cartilagini, Tendini e Legamenti). Le proprietà della Boswellia Serrata sono ampiamente riconosciute in letteratura, al punto che lo stesso Ministero della Salute ha rilasciato per questa sostanza il seguente Claim Ministeriale: “La Boswellia Serrata Sostiene la Funzionalità Articolare e Contrasta gli Stati di Tensione localizzati” [37-40].
In conclusione, come si è visto, da un punto di vista teorico l’associazione della VS con HA, di breve durata e ad azione relativamente rapida sull’articolazione, con un trattamento condroprotettivo ad azione lenta che permetta di prolungare il beneficio clinico agendo sugli stessi meccanismi fisiopatologici potrebbe avere un fondato razionale clinico. In realtà, ambedue i tipi di trattamento hanno un effetto nel proteggere la cartilagine articolare e ritardare la progressione della malattia e la loro azione potrebbe essere complementare e sinergica [41-44].
Anche dal punto di vista clinico, l’associazione di una VS intrarticolare con 3-5 iniezioni intrarticolari di HA a cadenza settimanale con un trattamento condroprotettivo orale di 3-6 mesi, che permetta di prolungare il beneficio clinico agendo sugli stessi meccanismi fisiopatologici, sembra ragionevole e supportato da iniziali evidenze sperimentali.
Nuovi studi si rendono quindi necessari al fine di validare con ancor maggior vigore quanto precedentemente descritto.
Dott. Alessandro Cerino – Specialista in Ortopedia e Traumatologia
BIBLIOGRAFIA
- Felson DT. Epidemiology of hip and knee osteoarthritis. Epidemiol Rev. 1988;10:1-28. doi:
10.1093/oxfordjournals.epirev.a036019. PMID: 3066625. - Abramoff B, Caldera FE. Osteoarthritis: Pathology, Diagnosis, and Treatment Options. Med Clin North Am. 2020 Mar;104(2):293-311. doi: 10.1016/j.mcna.2019.10.007. Epub 2019 Dec 18. PMID:
32035570. - Xia B, Di Chen, Zhang J, Hu S, Jin H, Tong P. Osteoarthritis pathogenesis: a review of molecular
mechanisms. Calcif Tissue Int. 2014 Dec;95(6):495-505. doi: 10.1007/s00223-014-9917-9. Epub 2014 Oct 14. PMID: 25311420; PMCID: PMC4747051. - MacDonald Wood A, Brock TM, Heil K, Holmes R, Weusten A. A Review on the Management of Hip
and Knee Osteoarthritis. Int J Chronic Dis. 2013; 2013: 845015. - Kolasinski SL et al. 2019 American College of Rheumatology/Arthritis
Foundation Guideline for the Management of Osteoarthritis of the Hand, Hip, and Knee.
Arthritis Care & Research 2020. DOI 10.1002/acr.24131 - Gamble R., Wyeth-Ayerst J., Johnson E. L., Searle W. A., Beecham S. Recommendations for the
medical management of osteoarthritis of the hip and knee. Arthritis and
Rheumatism. 2000;43(9):1905–1915. - Glyn-Jones S, Palmer AJ, Agricola R, et al. Osteoarthritis. Lancet 2015;386:376-87.
- Primorac D, Molnar V, Matišić V, et al. Comprehensive review of knee osteoarthritis pharmacological
treatment and the latest professional societies’ guidelines. Pharmaceuticals (Basel) 2021;14:205. - du Souich P. Absorption, distribution and mechanism of action of SYSADOAS. Pharmacol Ther
2014;142:362-374. - Sukhikh S, Babich O, Prosekov A, et al. Future of chondroprotectors in the treatment of degenerative
processes of connective tissue. Pharmaceuticals (Basel) 2020;13:220. - Honvo G, Reginster JY, Rabenda V, et al. Safety of symptomatic slow-acting drugs for osteoarthritis:
outcomes of a systematic review and meta-analysis. Drugs Aging 2019;36(Suppl 1):65-99. - Irsay L, Borda I, Ileana M, et al. Effectiveness of glucosamine and chondroitin sulfate combination in
patients with primary osteoarthritis. Appl Med Inform 2010;27:47-54. - Balazs EA, Denlinger JL. Viscosupplementation: a new concept in the treatment of osteoarthritis. J
Rheumatol 1993;20(Suppl 39):3-9. - Ong KL, Runa M, Lau E, Altman R. Is Intra-Articular Injection of SynviscAssociated with a Delay to Knee Arthroplasty in Patients with Knee Osteoarthritis? Cartilage. 2018;
- Turajane T, Amphansap T, Labpiboonpong V, Maungsiri S.J. Total knee replacement following repeat
ed cycles of intra-articular sodiumhyaluronate (500-730 Kda) in failed conservative treatment of knee osteoarthritis: a 54-month follow-up. MedAssoc Thai. 2009 Dec;92 Suppl6:S63-8. - Bowman S, Awad ME, Hamrick MW, Hunter M, Fulzele S. Recent advances in hyaluronic acid based
therapy for osteoarthritis. Clin Transl Med. 2018;7(1):6. - Lazzaro F. Study on greater clinical efficacy of intra-articular injection therapy with hyaluronic acid
(mw ≥1000 KDa) for mild-to-moderate knee osteoarthritis combined with oral chondroprotection.
GIOT. 2013;39:96-103. - P.G. Mitchell, H.A. Magna, S.A. Yocum, et al., J. Clin. Invest. 97 (1996) 761–768.
- D.J. Shlopov, R.W. Lie, K.A. Hasty, et al., Arthritis Rheum. 40 (1997) 2065–2074.
- K. Imai, S. Ohta, T. Matsumoto, Y. Okada, Am. J. Pathol. 151 (1997) 245–256.
- S. Ohta, K. Imai, K. Yamashita, Y. Okada, Lab. Investig. 78 (1998) 79–87.
- Mehana EE, Khafaga AF, El-Blehi SS. The role of matrix metalloproteinases in osteoarthritis
pathogenesis: An updated review. Life Sci. 2019 Oct 1;234:116786. doi: 10.1016/j.lfs.2019.116786.
Epub 2019 Aug 22. PMID: 31445934. - Xie XW, Wan RZ, Liu ZP. Recent Research Advances in Selective Matrix Metalloproteinase-13
Inhibitors as Anti-Osteoarthritis Agents. ChemMedChem. 2017 Aug 8;12(15):1157-1168. doi:
10.1002/cmdc.201700349. Epub 2017 Jul 19. PMID: 28722301. - Mason V., Fratter A., Pellizzato M. Efficacy and absorption of hyaluronic acid and N-acetyl-D-
glucosamine for the treatment of osteoarthritis: a review. Nutrafoods (2018) 17:89-95. - Richy F, Bruyere O, Ethgen O, Cucherat M, Henrotin Y, Reginster JY. Structural and symptomatic
efficacy of glucosamine and chondroitin in knee osteoarthritis: a comprehensive meta-analysis. Arch
Intern Med. 2003;163:1514–22. - Glucosamine sulfate in the treatment of knee osteoarthritis symptoms: a randomized, double- blind,
placebo-controlled study using acetaminophen as a side comparator. Herrero-Beaumont G, Ivorra
JA, Del Carmen Trabado M, Blanco FJ, Benito P, Martín-Mola E, Paulino J, Marenco JL, Porto A, Laffon A, Araújo D, Figueroa M, Branco J Arthritis Rheum. 2007 Feb; 56(2):555-67. - Chondroprotective activity of N-acetylglucosamine in rabbits with experimental osteoarthritis.
Shikhman AR, Amiel D, D’Lima D, Hwang SB, Hu C, Xu A, Hashimoto S, Kobayashi K, Sasho T, Lotz MK Ann Rheum Dis. 2005 Jan; 64(1):89-94. - Structure-modifying effects of chondroitin sulfate in knee osteoarthritis: an updated meta- analysis
of randomized placebo-controlled trials of 2-year duration. Hochberg MC Osteoarthritis Cartilage.
2010 Jun; 18 Suppl 1():S28-31. - Chondroitin sulphate reduces both cartilage volume loss and bone marrow lesions in knee
osteoarthritis patients starting as early as 6 months after initiation of therapy: a randomised, double-blind, placebo-controlled pilot study using MRI. Wildi LM, Raynauld JP, Martel-Pelletier J, Beaulieu A, Bessette L, Morin F, Abram F, Dorais M, Pelletier JP Ann Rheum Dis. 2011 Jun; 70(6):982- 9. - Lubis AMT, Siagian C, Wonggokusuma E, Marsetyo AF, Setyohadi B. Comparison of Glucosamine-
Chondroitin Sulfate with and without Methylsulfonylmethane in Grade I-II Knee Osteoarthritis: A
Double Blind Randomized Controlled Trial. Acta Med Indones. 2017 Apr;49(2):105- 111. - Notarnicola A, Maccagnano G, Moretti L, et al. Methylsulfonylmethane and boswellic acids versus
glucosamine sulfate in the treatment of knee arthritis: Randomized trial. Int J Immunopathol
Pharmacol. 2016;29(1):140-146. - Usha, P.R., Naidu, M.U.R. Randomised, Double-Blind, Parallel, Placebo-Controlled Study of Oral
Glucosamine, Methylsulfonylmethane and their Combination in Osteoarthritis. Clin. Drug Investig.
24, 353–363 (2004). - Butawan M, Benjamin RL, Bloomer RJ. Methylsulfonylmethane: Applications and Safety of a Novel
Dietary Supplement. Nutrients. 2017;9(3):290. - Debbi EM, Agar G, Fichman G, Ziv YB, Kardosh R, Halperin N, Elbaz A, Beer Y, Debi R. Efficacy of
methylsulfonylmethane supplementation on osteoarthritis of the knee: a randomized controlled
study. BMC Complement Altern Med. 2011 Jun 27;11:50. - Kim LS, Axelrod LJ, Howard P, Buratovich N, Waters RF. Efficacy of methylsulfonylmethane (MSM) in
osteoarthritis pain of the knee: a pilot clinical trial. Osteoarthritis Cartilage. 2006 Mar;14(3):286-94. - Siddiqui MZ. Boswellia serrata, a potential antiinflammatory agent: an overview. Indian J Pharm Sci.
2011 May;73(3):255-61. doi: 10.4103/0250-474X.93507. PMID: 22457547; PMCID: PMC3309643. - Yu, G., Xiang, W., Zhang, T. et al. Effectiveness of Boswellia and Boswellia extract for osteoarthritis
patients: a systematic review and meta-analysis. BMC Complement Med Ther 20, 225 (2020). - Majeed M, Majeed S, Narayanan NK, Nagabhushanam K. A pilot, randomized, double-blind, placebo-
controlled trial to assess the safety and efficacy of a novel Boswellia serrata extract in the
management of osteoarthritis of the knee. Phytother Res. 2019 May;33(5):1457-1468. - Sontakke S, Thawani V, Pimpalkhute S, Kabra P, Babhulkar S, Hingorani L. Open, randomized,
controlled clinical trial of Boswellia serrata extract as compared to valdecoxib in osteoarthritis of
knee. Indian Journal of Pharmacology; Pondicherry Vol. 39, Fasc. 1, (Jan/Feb 2007): 27-29. - Kimmatkar N, Thawani V, Hingorani L, Khiyani R. Efficacy and tolerability of Boswellia serrata extract in treatment of osteoarthritis of knee–a randomized double blind placebo controlled trial.
Phytomedicine. 2003 Jan;10(1):3-7. - Bruyère O, Honvo G, Veronese N, et al. An updated algorithm recommendation for the management
of knee osteoarthritis from the European Society for Clinical and Economic Aspects of Osteoporosis,
Osteoarthritis and Musculoskeletal Diseases (ESCEO). Semin Arthritis Rheum 2019;49:337- 350. - Bruyere O, Pavelka K, Rovati LC, et al. Total joint replacement after glucosamine sulphate treatment
in knee osteoarthritis: results of a mean 8-year observation of patients from two previous 3-year,
randomised, placebo-controlled trials. Osteoarthritis Cartilage 2008;16:254-260. - Altman R, Lim S, Steen RG, Dasa V. Hyaluronic acid injections are associated with delay of total knee
replacement surgery in patients with knee osteoarthritis: evidence from a large U.S. health claims
database. PLoS One 2015;10:e0145776. - Ong KL, Anderson AF, Niazi F, et al. Hyaluronic acid injections in Medicare knee osteoarthritis patients are associated with longer time to knee arthroplasty. J Arthroplast 2016;31:1667- 1673.
MIGLIORAMENTO DEGLI INDICI CLINIMETRICI IN PAZIENTI CON ARTROSI DOPO IL TRATTAMENTO CON UN PRODOTTO A BASE DI N-ACETIL-D-GLUCOSAMINA, CONDOITIN SOLFATO, METILSULFONILMETANO (MSM), BOSWELLIA SERRATA, SILICE E VITAMINA C
by dott. Marco Tasso | 4 Marzo 2024 | Articoli | 0 Comments
L’osteoartrosi (OA) è una delle malattie croniche più diffuse e invalidanti che colpiscono gli adulti. La sua caratteristica più importante è la progressiva perdita di integrità della cartilagine articolare dovuta ad una maggiore azione catabolica del condrocita in combinazione con cambiamenti nelle ossa sottostanti e nei margini articolari [1] che provoca una compromissione del movimento articolare, un forte dolore e, in definitiva, la disabilità.
La sua elevata prevalenza e il suo impatto da moderato a grave sulla vita quotidiana pongono un significativo problema di salute pubblica [2].
Oggi, una cura per l’OA rimane sfuggente per cui, la sua gestione si concentra principalmente sull’attenuazione della sintomatologia associata. Le attuali raccomandazioni includono una combinazione di interventi non farmacologici come: la perdita di peso, programmi educativi, l’esercizio fisico e così via e farmacologici che precisamente riferiscono all’utilizzo di farmaci di natura differente come: paracetamolo, farmaci antinfiammatori non steroidei (FANS) e così via [3]. Tra questi, i FANS attualmente risultano essere quelli maggiormente prescritti [4] nonostante i documentati gravi affetti avversi associati al loro uso nel lungo termine.
In questo contesto, diventano necessari trattamenti alternativi sicuri ed efficaci, ma soprattutto si rafforza l’importanza della prevenzione il che si traduce, sempre più spesso, nell’impiego di nutraceutici ad azione condroprotettrice ed antinfiammatoria la cui composizione è per lo più rappresentata da molecole come le SYSADOA (SYmptomatic Slow-Acting Drugs) ovvero: N-Acetil-D-Glucosamina e Condroitin solfato [5-9] in combinazione con Metilsulfonilmetano e Boswellia serrata [9-15].
Con le premesse appena esposte, è stato condotto uno studio osservazionale in aperto monocentrico al fine di valutare l’impatto su alcuni indici clinimetrici dell’utilizzo di un integratore alimentare a base di N-Acetil-D-Glucosamina, Condoitin solfato, Metilsulfonilmetano (MSM), Boswellia serrata tit. al 65% in acidi boswellici, Silice e Vitamina C.
L’aggiunta in formulazione di attivi come il Biossido di Silicio e la Vitamina C è stata valutata in relazione a comprovate evidenze scientifiche [16-18] che hanno condotto alla costituzione di relativi claims EFSA.
I 30 pazienti (23 donne e 7 uomini) reclutati affetti da una condizione artrosica generalizzata con un’età mediadi 63 anni, hanno ricevuto il nutraceutico per un arco temporale di tre mesi.
La posologia prevedeva l’assunzione di una bustina al giorno (30 minuti dopo colazione o pranzo) ognuna delle quali conteneva i seguenti dosaggi:
| N-Acetil-D-Glucosamina | 500 mg |
| Condroitin solfato | 400 mg |
| Metilsulfonilmetano (MSM) | 2500 mg |
| Boswellia serrata e.s. tit. 65% in acidi boswellici (di cui acidi boswellici) | 300 mg (195 mg) |
| Silice | 20 mg |
| Vitamina C | 80mg (100% VNR) |
Il follow-up prevedeva una visita al basale corrispondente a T0 ed una seconda visita di controllo corrispondente a T1 a tre mesi dall’inizio del trattamento. Durante entrambe le visite, allo scopo di monitorare l’andamento della terapia, sono stati esaminati attraverso l’utilizzo di strumenti ben precisi, i seguenti endpoints:
- La riduzione del dolore articolare;
- La riduzione della rigidità articolare mattutina;
- La riduzione dell’indice di disabilità
Il dolore articolare è stato valutato mediante l’utilizzo della scala VAS (Visual Analogue Scale) [19] ovvero, uno dei parametri maggiormente impiegati per stimare l’intensità e l’entità di sollievo dello stesso nei pazienti adulti. Il dolore è un sintomo soggettivo, cioè percepito in modo differente da ciascun soggetto e soprattutto difficile da descrivere oltre che allo stesso modo complesso da percepire nella sua reale entità da parte di chi ascolta.
La scala VAS, pertanto, si dimostra lo strumento di valutazione ottimale a tale scopo in quanto è di semplice utilizzo, riproducibile, e rapido.
Ai pazienti è stato chiesto di valutare l’intensità del dolore provato nelle ultime 24 ore classificandolo con un punteggio da 0 a 10 dove 0 indicava intensità nulla e 10 intensità massima.
La rigidità articolare mattutina invece, è stata valutata su 4 livelli differenti:
- Nessuna;
- Lieve;
- Moderata;
- Severa.
Anche in questo caso si è richiesta una valutazione soggettiva da parte del paziente catalogando la rigidità articolare percepita appena svegli in una delle sopraelencate categorie.
Infine, l’Health Assessment Questionnaire (HAQ) è stato lo strumento utilizzato per la valutazione dell’indice di disabilità [20].
Nello specifico, con HAQ si fa riferimento ad una misurazione della capacità funzionale, rapido e facile da calcolare utile nel valutare la risposta a breve termine al trattamento.
L’HAQ che regolarmente comprende 20 quesiti riguardanti attività della vita quotidiana, suddivisi in 8 categorie (lavarsi e vestirsi, alzarsi, camminare, igiene personale, mangiare, raggiungere ed afferrare oggetti, attività più complesse), è stato ridotto ad 8 quesiti ognuno rappresentativo di una singola categoria. Le risposte possibili per ogni quesito erano 4, in relazione al grado di difficoltà che comportava l’azione richiesta:
- 0 = senza difficoltà
- 1 = con qualche difficoltà
- 2 = con molta difficoltà
- 3 = non possibile
La somma dei punteggi (da 0 a 24) diviso 8, rappresentava il punteggio finale dell’HAQ.
Definiti i materiali e metodi utilizzati, possiamo passare all’analisi dei risultati.
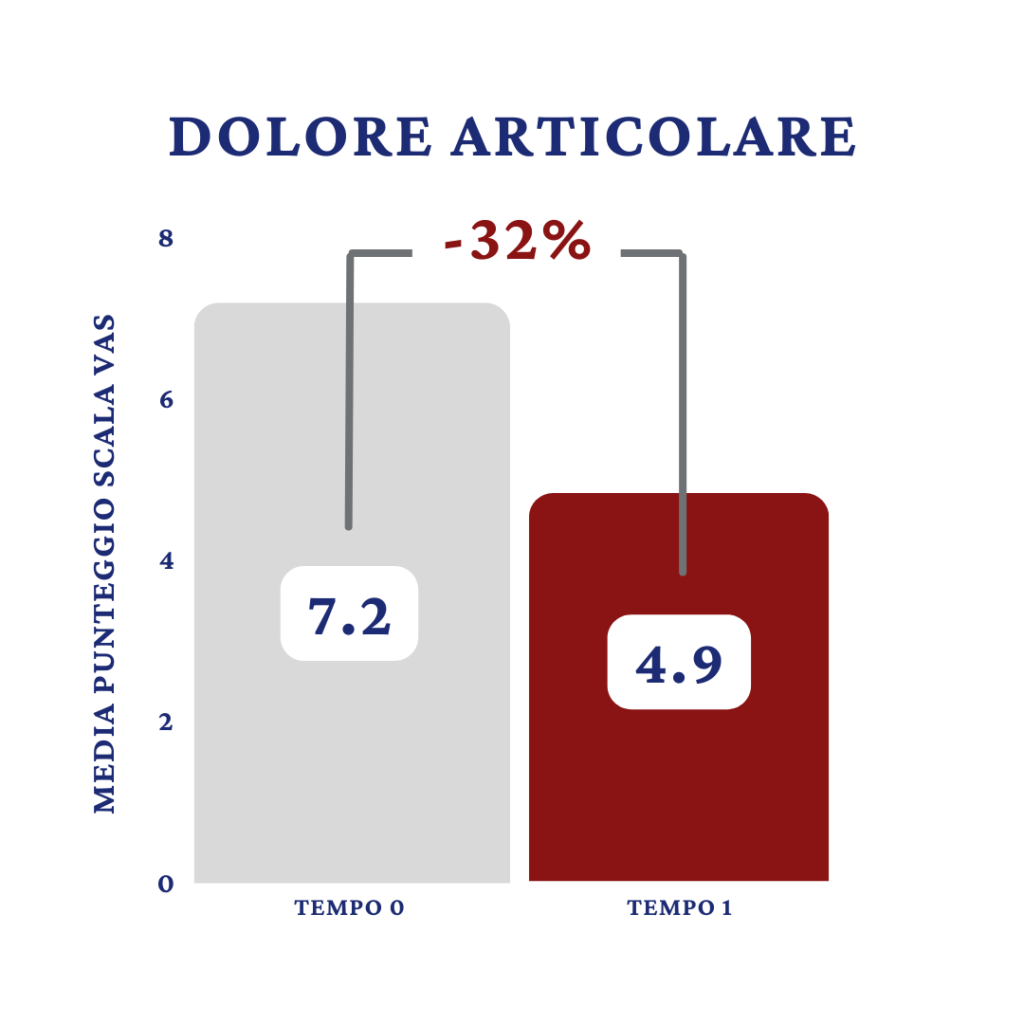
Gli esiti sull’indice di dolorabilità ottenuti (Fig.1), hanno evidenziato che la media del punteggio della scala VAS è passato da 7,2 al basale (T0) a 4,9 al controllo (T1) assistendo così ad una riduzione percentuale del valore medio del 32%.
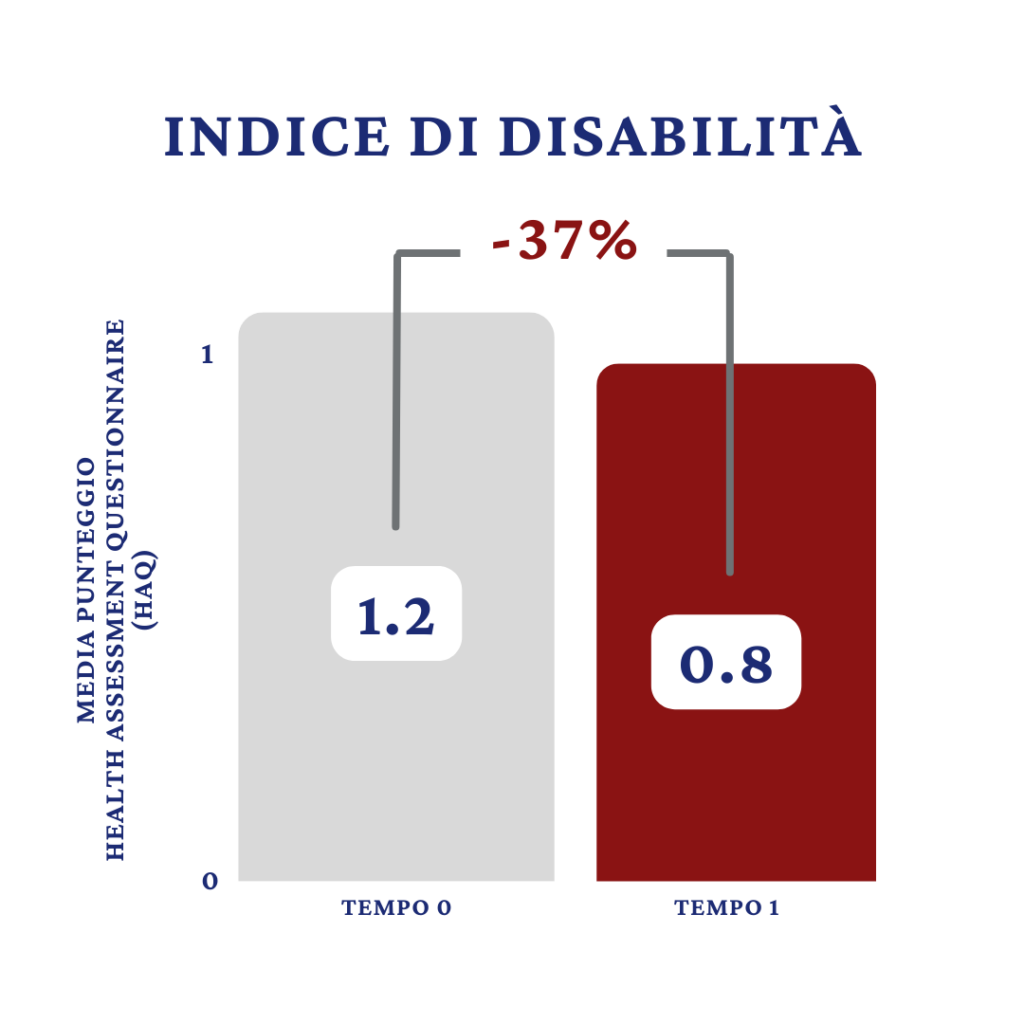
Anche la media del punteggio HAQ ha subito una variazione (Fig.2) tra Il basale (T0) ed il controllo (T1). Più precisamente, si è passati da un valore di 1,2 a T0 ad uno di 0,8 a T1 il che si traduce con una riduzione percentuale del valore medio pari al 37%
L’ultimo endpoint esaminato è stato quello della rigidità articolare mattutina (Fig.3). I 30 pazienti valutati al basale (T0) avevano una distribuzione per categoria pari a:
- 2 con assenza di rigidità
- 12 con rigidità lieve
- 14 con rigidità moderata
- 2 con rigidità severa
Al controllo (T1) si è assistito ad una ridistribuzione delle categorie così come segue:
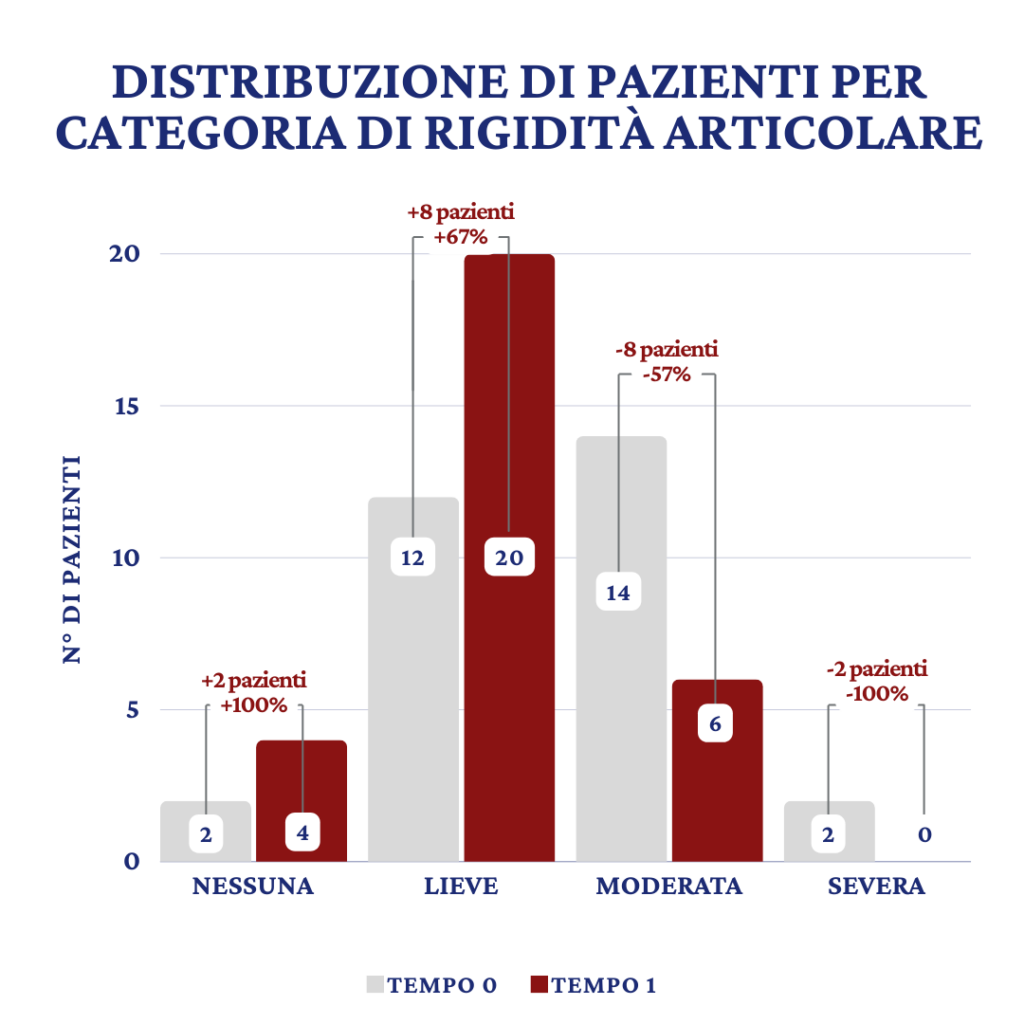
- 4 con assenza di rigidità
- 20 con rigidità lieve
- 6 con rigidità moderata
- 0 con rigidità severa
l risultato ottenuto, indica una variazione percentuale vantaggiosa dei pazienti all’interno della stessa categoria tra il basale (T0) ed il controllo (T1) in quanto, a conclusione del periodo di trattamento, gran parte dei pazienti in studio presentavano una rigidità articolare mattutina assente o lieve.
La ridistribuzione positiva della popolazione esaminata nelle categorie di rigidità può essere facilmente compresa anche dai dati percentuali evidenziabili in Fig. 4.
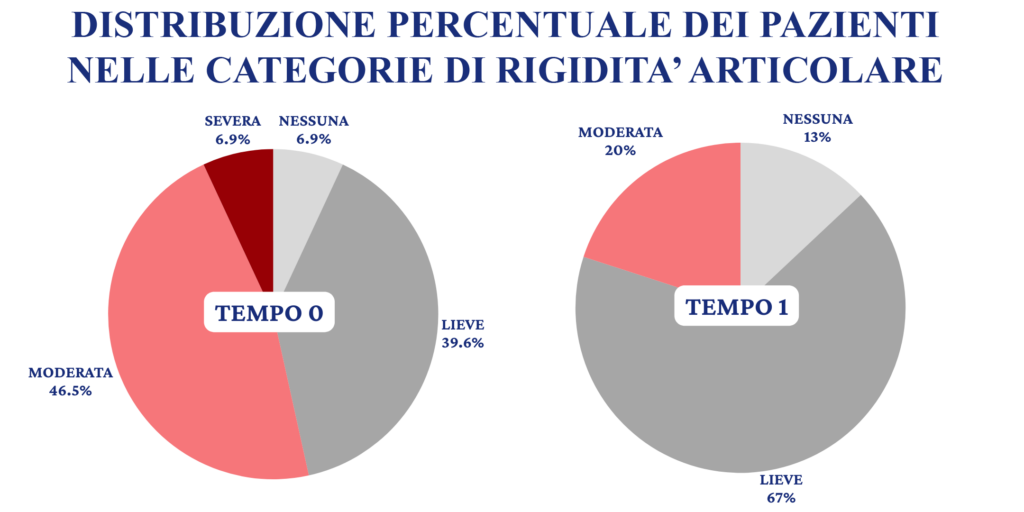
È constatabile come i pazienti con una rigidità articolare mattutina riferita tra l’assente ed il lieve raggiunga un valore del 79% sul totale dei pazienti esaminati al controllo (T1) rispetto al 47% del basale (T0).
In conclusione, l’utilizzo trimestrale di un integratore a base di N-Acetil-D-Glucosamina, Condoitin solfato, Metilsulfonilmetano (MSM), Boswellia serrata tit. al 65% in acidi boswellici, Silice e Vitamina C ha avuto un impatto positivo sulla riduzione del dolore articolare, sulla riduzione della rigidità articolare mattutina e sulla riduzione dell’indice di disabilità dei pazienti esaminati.
I risultati del presente studio osservazionale sommati alle numerose e promettenti basi scientifiche pongono l’accento sulla possibilità che la supplementazione nutrizionale rappresenti un’importante alternativa terapeutica per la gestione dell’ostoartrosi (soprattutto in tema di prevenzione) od una valida terapia di associazione al classico trattamento farmacologico.
La necessità di approfondire ulteriormente l’argomento con studi clinici randomizzati e controllati è però fondamentale al fine di indagare con maggiore cura ed eventualmente confutare con dati ancor più concreti i potenziali benefici del trattamento combinato di questi principi attivi nella patologia osteoartrosica.
Dott. Marco Tasso – Specialista in Ortopedia e Traumatologia
BIBLIOGRAFIA
- Suri P, Morgenroth DC, Hunter DJ. Epidemiology of osteoarthritis and associated comorbidities. PMR. 2012 May;4(5 Suppl):S10-9. doi: 10.1016/j.pmrj.2012.01.007. PMID: 22632687.
- Yelin E. The economics of osteoarthritis. In: Brandt KD, Doherty M, Lohmander LS, editor. Osteoarthritis. Oxford: Oxford University Press; 2003. pp. 17–21.
- Jordan KM, Arden NK, Doherty M, Bannwarth B, Bijlsma JW, Dieppe P, Gunther K, Hauselmann H, Herrero-Beaumont G, Kaklamanis P, et al. EULAR Recommendations 2003: an evidence based approach to the management of knee osteoarthritis: Report of a Task Force of the Standing Committee for International Clinical Studies Including Therapeutic Trials (ESCISIT) Ann Rheum Dis. 2003;62:1145–1155. doi: 10.1136/ard.2003.011742.
- Abramson SB. The role of NSAIDs in the treatment of osteoarthritis. In: Brandt KD, Doherty M, Lohmander LS, editor. Osteoarthritis. Oxford: Oxford University Press; 2003. pp. 251–258.
- Honvo G, Reginster JY, Rabenda V, Geerinck A, Mkinsi O, Charles A, Rizzoli R, Cooper C, Avouac B, Bruyère O. Safety of Symptomatic Slow-Acting Drugs for Osteoarthritis: Outcomes of a Systematic Review and Meta-Analysis. Drugs Aging. 2019 Apr;36(Suppl 1):65-99. doi: 10.1007/s40266-019-00662-z. PMID: 31073924; PMCID: PMC6509099.
- Rubin BR, Talent JM, Kongtawelert P, Pertusi RM, Forman MD, Gracy RW. Oral polymeric N-acetyl-D-glucosamine and osteoarthritis. J Am Osteopath Assoc. 2001 Jun;101(6):339-44. PMID: 11432083.
- Pecchi E, Priam S, Mladenovic Z, Gosset M, Saurel AS, Aguilar L, Berenbaum F, Jacques C. A potential role of chondroitin sulfate on bone in osteoarthritis: inhibition of prostaglandin E₂ and matrix metalloproteinases synthesis in interleukin-1β-stimulated osteoblasts. Osteoarthritis Cartilage. 2012 Feb;20(2):127-35. doi: 10.1016/j.joca.2011.12.002. Epub 2011 Dec 11. PMID: 22179028.
- Henrotin Y, Lambert C. Chondroitin and glucosamine in the management of osteoarthritis: an update. Curr Rheumatol Rep. 2013 Oct;15(10):361. doi: 10.1007/s11926-013-0361-z. PMID: 23955063.
- Stuber K, Sajko S, Kristmanson K. Efficacy of glucosamine, chondroitin, and methylsulfonylmethane for spinal degenerative joint disease and degenerative disc disease: a systematic review. J Can Chiropr Assoc. 2011 Mar;55(1):47-55. PMID: 21403782; PMCID: PMC3044807.
- Notarnicola A, Maccagnano G, Moretti L, et al. Methylsulfonylmethane and boswellic acids versus glucosamine sulfate in the treatment of knee arthritis: Randomized trial. Int J Immunopathol Pharmacol. 2016;29(1):140-146.
- Usha, P.R., Naidu, M.U.R. Randomised, Double-Blind, Parallel, Placebo-Controlled Study of Oral Glucosamine, Methylsulfonylmethane and their Combination in Osteoarthritis. Clin. Drug Investig. 24, 353–363 (2004).
- Yu, G., Xiang, W., Zhang, T. et al. Effectiveness of Boswellia and Boswellia extract for osteoarthritis patients: a systematic review and meta-analysis. BMC Complement Med Ther 20, 225 (2020).
- Majeed M, Majeed S, Narayanan NK, Nagabhushanam K. A pilot, randomized, double-blind, placebo-controlled trial to assess the safety and efficacy of a novel Boswellia serrata extract in the management of osteoarthritis of the knee. Phytother Res. 2019 May;33(5):1457-1468.
- Sontakke S, Thawani V, Pimpalkhute S, Kabra P, Babhulkar S, Hingorani L. Open, randomized, controlled clinical trial of Boswellia serrata extract as compared to valdecoxib in osteoarthritis of knee. Indian Journal of Pharmacology; Pondicherry Vol. 39, Fasc. 1, (Jan/Feb 2007): 27-29.
- Kimmatkar N, Thawani V, Hingorani L, Khiyani R. Efficacy and tolerability of Boswellia serrata extract in treatment of osteoarthritis of knee–a randomized double blind placebo controlled trial. Phytomedicine.
- Murad S, Grove D, Lindberg KA, Reynolds G, Sivarajah A, Pinnell SR. Regulation of collagen synthesis by ascorbic acid. Proc Natl Acad Sci U S A. 1981 May;78(5):2879-82. doi: 10.1073/pnas.78.5.2879. PMID: 6265920; PMCID: PMC319462.
- Pinnell SR. Regulation of collagen biosynthesis by ascorbic acid: a review. Yale J Biol Med. 1985 Nov-Dec; 58(6):553-9. PMID: 3008449; PMCID: PMC2589959.
- 18. Jugdaohsingh R. Silicon and bone health. J Nutr Health Aging. 2007 Mar-Apr;11(2):99-110. PMID: 17435952; PMCID: PMC2658806.
- Williamson A, Hoggart B. Pain: a review of three commonly used pain rating scales. J Clin Nurs. 2005 Aug;14(7):798-804. doi: 10.1111/j.1365-2702.2005.01121.x. PMID: 16000093.
- Wylde V, Livesey C, Learmonth ID, Blom AW, Hewlett S. Evaluation of the Personal Impact Health Assessment Questionnaire (PI HAQ) to capture the impact of disability in osteoarthritis. Musculoskeletal Care. 2010 Jun;8(2):87-98. doi: 10.1002/msc.170. PMID: 20232480.

PHARMACEUTICAL CARE: LA NUOVA FRONTIERA DELLA SALUTE
by Medin Blog | 10 Dicembre 2020 | Video | 0 Comments
La Farmacia dei Servizi rappresenta il punto di arrivo dell’evoluzione di questa professione.
In un contesto sociale sempre più smart e in continuo cambiamento, gli attori principali di questo scenario sono Farmacisti, Medici e Pazienti, che oggi più che mai hanno bisogno di uno spazio comunicativo digitale, dinamico e interattivo.
Dall’analisi delle esigenze di queste categorie nasce il nostro progetto, Medin Service, che vuole dare risposte e supporto ai Professionisti della Salute per la cura dei Pazienti.
I BENEFICI DELLA MAGNETOTERAPIA
by Medin Blog | 10 Dicembre 2020 | Video | 0 Comments
La magnetoterapia è una tecnica che sfrutta i benefici dei campi magnetici a scopo curativo e riabilitativo. Per capire bene come funziona, è necessario illustrare innanzitutto il concetto di campo magnetico. Se applicata sul nostro corpo, l’azione dei campi magnetici è in grado di ristabilire l’equilibrio biochimico delle cellule qualora questo sia compromesso, ripristinando la corretta funzionalità della membrana cellulare. La magnetoterapia agisce soprattutto sul sistema osseo, articolare, muscolare e vascolare. Schematizzando, ecco quali sono i principali benefici per il nostro organismo:
- espleta un’azione antinfiammatoria
- ha un effetto antalgico/antidolorifico
- accelera la calcificazione delle fratture
- aumenta l’irrorazione vascolare e la velocità di scorrimento del sangue
- migliora la circolazione periferica
- accelera la cicatrizzazione di ferite, piaghe, e la guarigione dei tessuti molli
- migliora il metabolismo della cute
- svolge un’azione antinvecchiamento dei tessuti.
I contenuti di questo articolo sono pubblicati solo a scopo informativo, pertanto non sostituiscono il parere del medico.
FONTI
F. Ambrosi, “Magnetoterapia a campo stabile”.
W. Hulke. “Magnetoterapia. Principi fondamentali ed effetti terapeutici”.
I nostri Articoli
L’AZIONE MIORILASSANTE DEI NUTRACEUTICI NELLA GESTIONE DELLA CERVICALGIA: MECCANISMI FISIOLOGICI ED EVIDENZE CLINICHE
by Dott. Vincenzo Secondulfo | Feb 2, 2026
L’UTILLIZZO DEL SELENIO NEL TRATTAMENTO DELLE TIROIDITI CRONICHE IN PAZIENTI IN EUTIREOSI
by Dott.ssa Luciana Vergnani | Gen 29, 2026
NUOVE SOLUZIONE CONSERVATIVE NEL TRATTAMENTO DELL’OSTEOARTROSI: CONDROPROTEZIONE E VISCOSUPPLEMENTAZIONE
by Dott. Alessandro Cerino | Apr 23, 2024
MIGLIORAMENTO DEGLI INDICI CLINIMETRICI IN PAZIENTI CON ARTROSI DOPO IL TRATTAMENTO CON UN PRODOTTO A BASE DI N-ACETIL-D-GLUCOSAMINA, CONDOITIN SOLFATO, METILSULFONILMETANO (MSM), BOSWELLIA SERRATA, SILICE E VITAMINA C
by dott. Marco Tasso | Mar 4, 2024
L’IMPIEGO DI ATTIVI NATURALI NELLA GESTIONE DEL PAZIENTE GONARTROSICO
by Dott. Raffaele Franzese | Feb 15, 2024
IMPIEGO DEI NUTRACEUTICI NEL TRATTAMENTO CRONICO DEI PAZIENTI FIBROMIALGICI
by Dott. Pasquale Cozzolino | Gen 2, 2024
I nostri Video
PHARMACEUTICAL CARE: LA NUOVA FRONTIERA DELLA SALUTE
by Medin Blog | Dic 10, 2020
I BENEFICI DELLA MAGNETOTERAPIA
by Medin Blog | Dic 10, 2020